
| 1×10-14 |
| 1×10-13 |
| 4g |
| 5g |


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.20 | 24.00 |
| 第三次 | 10.00 | 0.40 | 21.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ①O2 |
| ②ZnH2O |
 是一种合成药物的中间体,请写出以CH2(COOH)2、CH2Cl2 及
是一种合成药物的中间体,请写出以CH2(COOH)2、CH2Cl2 及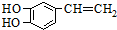 为原料制备该化合物,合成该化合物路线流程图(无机试剂任用),
为原料制备该化合物,合成该化合物路线流程图(无机试剂任用),| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:6 | B、6:1 |
| C、1:5 | D、5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食盐加碘,碘元素百分含量越高,食盐的质量越高 |
| B、菜炒熟出锅前再放碘盐以防分解,加醋会降低碘的利用率 |
| C、苯甲酸钠是常用的食品调味剂 |
| D、腌制肉食制品使用的亚硝酸盐即使不超标,也不可长期或大量的进食 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com