
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
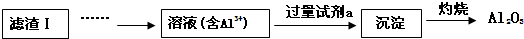
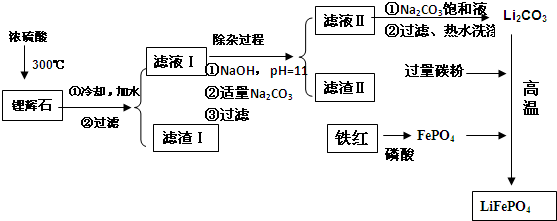
分析 锂辉石中加入硫酸后,依据已知:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓,Al2O3•4SiO2•H2O沉淀出来,即滤渣I,滤液I中含有Li2SO4、MgSO4、CaSO4,向滤液中加入NaOH、Na2CO3,镁离子和NaOH反应生成氢氧化镁沉淀,钙离子和碳酸钠反应生成碳酸钙沉淀,所以滤渣II为Mg(OH)2、CaCO3,滤液II中含有硫酸锂,向滤液中加入饱和碳酸钠得到碳酸锂沉淀,铁和磷酸反应生成磷酸铁,C、磷酸铁和碳酸锂在高温下反应生成LiFePO4,据此分析解答.
解答 解:(1)从滤渣Ⅰ溶于酸得到铝离子,氢氧化铝不溶于弱碱但能溶于强碱,所以a为氨水,向溶液中加入氨水得到Al(OH)3沉淀,灼烧Al(OH)3沉淀得到Al2O3,所以生成沉淀反应即铝离子与氨水反应生成氢氧化铝沉淀,离子反应方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(2)滤液I中存在Ca2+、Mg2+离子,经过调解pH值后,Ca2+、Mg2+沉淀分别得到氢氧化镁和碳酸钙,所以滤渣Ⅱ的主要成分是Mg(OH)2、CaCO3,故答案为:Mg(OH)2、CaCO3;
(3)向滤液II中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”,图表中碳酸锂溶解度随温度升高减小,减少沉淀的损失,故答案为:Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失;
(4)依据图示可知反应物为FePO4、Li2CO3和C,产物为:CO和LiFePO4,此反应为氧化还原反应,Fe、和C元素化合价变化,依据氧化还原反应原理配平化学反应方程式为:2FePO4+Li2CO3+2C $\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑,故答案为:2FePO4+Li2CO3+2C $\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑;
(5)电池放电时原电池原理,Li失电子发生氧化反应做原电池负极,FePO4在正极得到电子发生还原反应生成LiFePO4,电极反应为:FePO4+Li++e-=LiFePO4;
若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况)产生时,气体物质的量为0.2mol,生成氢气物质的量0.1mol,依据电子守恒和电极反应计算,
H2~2Li~2e-
0.1mol 0.2mol
消耗锂的质量=0.2mol×7g/mol=1.4g,
故答案为:FePO4+Li++e-=LiFePO4;1.4g.
点评 本题考查物质的分离和提纯,综合性较强,涉及原电池原理、物质分离和提纯试剂的选取等知识点,明确化学反应原理、物质性质及性质差异性是解本题关键,侧重考查学生分析计算及综合知识运用能力,难点是电极反应式的书写.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(A)/mol | n(B)/mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | 0.20 |
| A. | 前10min内反应的平均速率为v(C)=0.050mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.50molA气体和0.60molB气体,到达平衡时,n(C)<0.25mol | |
| C. | 若密闭容器体积不变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动 | |
| D. | 温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
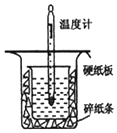 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:| 序号 | 起始温度t1/℃ | 终止温度t2/℃ | t2-t1均值 | ||
| H2SO4 | NaOH | 均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29,6 | |
| 2 | 29.0 | 29.4 | 29,2 | 32.9 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com