
下列关于0.10mol•L﹣1 NaHCO3溶液的说法正确的是()
A. 溶质的电离方程式为NaHCO3═Na++H++CO32﹣
B. 25℃时,加水稀释后,n(H+)与n(OH﹣)的乘积变大
C. 离子浓度关系:c(Na+)+c(H+)=c(OH﹣)+c(HCO3﹣)+c(CO32﹣)
D. 温度升高,c(HCO3﹣)增大
考点: 真题集萃;盐类水解的应用;离子浓度大小的比较.
专题: 盐类的水解专题.
分析: A.碳酸氢根离子不可拆分;
B.加水稀释后,促进HCO3﹣水解,但Kw不变;
C.溶液遵循电荷守恒;
D.HCO3﹣水解为吸热反应,升高温度,促进水解.
解答: 解:A.NaHCO3为强电解质,溶质的电离方程式为NaHCO3═Na++HCO3﹣,故A错误;
B.25℃时,加水稀释后,促进HCO3﹣水解,n(OH﹣)增大,c(OH﹣)减小,由Kw不变,可知c(H+)增大,则n(H+)增大,则n(H+)与n(OH﹣)的乘积变大,故B正确;
C.由电荷守恒可知,离子浓度关系:c(Na+)+c(H+)=c(OH﹣)+c(HCO3﹣)+2c(CO32﹣),故C错误;
D.HCO3﹣水解为吸热反应,升高温度,促进水解,则c(HCO3﹣)减小,故D错误;
故选B.
点评: 本题为2014年福建2015届高考化学试题,涉及电离、水解及溶液中离子浓度关系的考查,选项B为解答的易错点,注意稀释促进水解时浓度与物质的量的变化不同,题目难度中等.


科目:高中化学 来源: 题型:
硅及其化合物在材料领域中应用广泛.下列叙述中不正确的是( )
A. 硅单质可用来制造太阳能电池
B. 装碱性溶液的玻璃试剂瓶不能用玻璃塞
C. 二氧化硅是制造光导纤维的材料
D. 二氧化硅属于酸性氧化物,不能与任何酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在同温同压下,下列各组热化学方程式中,△H1>△H2的是()
A. 2H2(g)+O2(g)═2H2O(l)△H1;2H2(g)+O2(g)═2H2O(g)△H2
B. S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2
C. C(s)+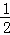 O2(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2
O2(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2
D. H2(g)+Cl2(g)═2HCl(g)△H1;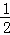 H2(g)+
H2(g)+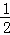 Cl2(g)═HCl(g)△H2
Cl2(g)═HCl(g)△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是()
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值.下列说法正确的是()
A. 1 mol甲苯含有C﹣H键数目为8NA
B. 1 mol丙烯酸中含有双键的数目为NA
C. 由a g C2H4和C3H6组成的混合物中所含共用电子对数目为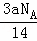
D. 在过氧化钠跟水的反应中,每生成2.24 L氧气,转移电子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
三草酸合铁酸钾(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.
完成下列填空:
某实验小组为测定该晶体中铁的含量和结晶水的含量,做了如下实验:
(一)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL 于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液将草酸根恰好全部氧化成CO2,MnO4﹣同时被还原为Mn2+.向反应后的溶液中加入锌粉,加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4﹣被还原成Mn2+.
重复步骤二和步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98mL.
(1)配制三草酸合铁酸钾溶液的操作步骤依次是:称量、溶解、冷却、转移、洗涤并转移、 、摇匀.
(2)加入锌粉的目的是 .
(3)写出步骤三中发生反应的离子方程式 .
(4)实验测得该晶体中铁的质量分数为 .在步骤二中,若滴加的KMnO4溶液的量不够,则测得的铁含量 .(选填“偏低”、“偏高”或“不变”)
(二)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.
(5)请纠正上述实验过程中的两处错误: .
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求完成下列问题:
(1)在25℃、101kPa下,1g甲醇(液体,分子式为CH3OH)燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为 ;将该反应设计成碱性燃料电池,写出该电池的负极电极反应方程式
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ•mol﹣1
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=﹣247.4kJ•mol﹣1
以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 .
(3)已知白磷、红磷燃烧的热化学方程式分别为:
P4(s,白磷)+5O2=P4O10(s);△H=﹣2986kJ•mol﹣1
4P(s,红磷)+5O2=P4O10(s);△H=﹣2956kJ•mol﹣1
则白磷比红磷 (填“稳定”或“不稳定”)
(4)已知一定条件下A2与B2自发反应生成AB3,则反应A2(g)+3B2(g)=2AB3(g) 的△S= 0,△H 0 (填“<”、“>”、“=”)
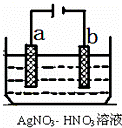
(5)如图为电解精炼银的示意图, a (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com