
【题目】(1)标准状况下有以下四种气体:
①6.72 L CH4 ②3.01×1023个HCl分子 ③2.404×1023个H2S分子 ④0.2 mol NH3
a.物质的量由小到大的顺序_____________________________________
b.质量由小到大的顺序_________________________________________
(2)12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为________,R的相对原子质量为________。含R的质量为1.6 g的Na2R,其物质的量为________。
(3)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中:混合气体的平均相对分子质量是________,对氢气的相对密度是________。
【答案】④<①<③<②④<①<③<②62 g·mol-1160.1 mol4020
【解析】
(1).根据n=![]() 计算甲烷物质的量,根据n=
计算甲烷物质的量,根据n=![]() 计算HCl和H2S的物质的量,根据m=n×M计算各物质的质量;(2). 根据化学式可知Na2R中n(Na+)=2n(Na2R),由M=
计算HCl和H2S的物质的量,根据m=n×M计算各物质的质量;(2). 根据化学式可知Na2R中n(Na+)=2n(Na2R),由M=![]() 计算Na2R的摩尔质量,当摩尔质量以g/mol为单位时,数值上等于其相对分子质量,据此计算R的相对原子质量,根据n=
计算Na2R的摩尔质量,当摩尔质量以g/mol为单位时,数值上等于其相对分子质量,据此计算R的相对原子质量,根据n=![]() 计算1.6gR的物质的量,再由n(Na2R)=n(R)计算Na2R的物质的量。(3).根据
计算1.6gR的物质的量,再由n(Na2R)=n(R)计算Na2R的物质的量。(3).根据![]() =
=![]() 计算混合气体的平均摩尔质量,进而确定平均相对分子质量;相对密度等于相对分子质量之比。
计算混合气体的平均摩尔质量,进而确定平均相对分子质量;相对密度等于相对分子质量之比。
(1).标准状况下,①.6.72 L CH4的物质的量为n(CH4)=![]() = 0.3mol,质量为m(CH4) = 0.3mol×16g/mol=4.8g;②.3.01×1023个HCl分子的物质的量为n(HCl)=
= 0.3mol,质量为m(CH4) = 0.3mol×16g/mol=4.8g;②.3.01×1023个HCl分子的物质的量为n(HCl)=![]() =0.5mol,质量为m(HCl) = 0.5mol×36.5g/mol=18.25g;③.2.404×1023个H2S分子的物质的量为n(H2S)=
=0.5mol,质量为m(HCl) = 0.5mol×36.5g/mol=18.25g;③.2.404×1023个H2S分子的物质的量为n(H2S)=![]() =0.4mol,质量为m(H2S) = 0.4mol×34g/mol=13.6g;④.0.2 mol NH3的质量为m(NH3) = 0.2mol×17/mol=3.4g。
=0.4mol,质量为m(H2S) = 0.4mol×34g/mol=13.6g;④.0.2 mol NH3的质量为m(NH3) = 0.2mol×17/mol=3.4g。
a.由上述计算可知,各物质的物质的量由小到大的顺序为④<①<③<②,故答案为:④<①<③<②;
b. 由上述计算可知,各物质的质量由小到大的顺序为④<①<③<②,故答案为:④<①<③<②;
(2). 根据化学式可知Na2R中n(Na+)=2n(Na2R),所以含有0.4molNa+的Na2R的物质的量为n(Na2R)=0.4mol÷2=0.2mol,则Na2R的摩尔质量为M(Na2R)=12.4g÷0.2mol=62 g·mol-1,当摩尔质量以g/mol为单位时,数值上等于其相对分子质量,即Na2R的相对分子质量为62,所以R的相对原子质量为62-23×2=16,1.6g R的物质的量为n(R)=1.6g÷16g/mol=0.1mol,根据化学式可知:n(Na2R)=n(R)=0.1mol,故答案为:62 g·mol-1;16;0.1mol;
(3). 在标准状况下,由CO和CO2组成的混合气体6.72 L,该混合气体的总物质的量为6.72L÷22.4L/mol=0.3mol,则混合气体的平均摩尔质量为![]() =
=![]() =
=![]() =40g/mol,当摩尔质量以g/mol为单位时,数值上等于其相对分子质量,所以该混合气体的平均相对分子质量为40,相对密度等于相对分子质量之比,则混合气体对氢气的相对密度为
=40g/mol,当摩尔质量以g/mol为单位时,数值上等于其相对分子质量,所以该混合气体的平均相对分子质量为40,相对密度等于相对分子质量之比,则混合气体对氢气的相对密度为![]() =20,故答案为:40;20。
=20,故答案为:40;20。


科目:高中化学 来源: 题型:
【题目】VL 浓度为1mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是
A.通入标准状况下的HC1气体22.4VL
B.将溶液加热浓缩到0.5VL
C.加入10mol·L-1的盐酸0.2VL,再稀释至1.5VL
D.加入VL3mol·L-1的盐酸混合均匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡移动原理同样也适用于其他平衡。已知在氨水中存在下列平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4+ +OH-
NH4+ +OH-
(1)向氨水中加入MgCl2固体时,平衡向____移动,OH-的浓度____(填“增大”“减小”或“不变”,下同), NH4+的浓度____。
(2)向氨水中加入浓盐酸,平衡向____移动。
(3)向浓氨水中加入少量NaOH固体,平衡向____移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为实验室某浓盐酸试剂瓶上的有关数据,该浓盐酸中HCl的物质的量浓度为________mol/L。某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.3 mol/L稀盐酸:

(2)该学生需要量取_______mL上述浓盐酸进行配制。
(3)配制过程中,除需要使用烧杯、量筒、玻璃棒外,还需要使用的仪器是(填写名称)_______、_______。
(4)配制时,其正确的操作顺序是(要求用字母表示,每个字母只能用一次)_____________________;
A.用30mL蒸馏水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量蒸馏水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加蒸馏水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻线1~2cm处
(5)在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是_____________________
A.摇匀后静置,发现液面低于刻度线,继续加水至与刻度线相切
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配制前用已知浓度的稀盐酸润洗容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状态下,将11.2 LHCl气体溶于水,制成250mL溶液。
(1)试求该盐酸溶液的物质的量浓度______;
(2)如果用质量分数为36.5%密度为1.2 g/cm3 的浓盐酸来配制上述溶液,则应量取该浓盐酸多少毫升进行稀释____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2·12H2O俗称铵明矾,其性质稳定,是化学实验常用的基准试剂,借助碳酸氢铵与硫酸钠可以制备纯净的铵明矾,制备过程如下图,下面相关说法错误的是
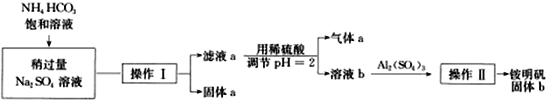
A. 为加快操作I的速率实验时采用抽滤,常用玻璃纤维替代滤纸
B. 操作I的基本过程为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
C. 使用NaOH和BaCl2试剂可以检验铵明矾的三种离子
D. 若气体a通入到饱和的纯碱溶液中会有晶体析出,该晶体与固体a相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列数量的各物质所含原子数按由大到小的顺序排列是________。
①0.5 mol氨气
②标准状况下22.4 L氦气
③4 ℃时9 mL水
④0.2 mol磷酸钠(Na3PO4)
(2)现有m g某气体,它是三原子分子,其摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为________mol。
②该气体所含原子总数为________个。
③该气体在标准状况下的体积为________L。
④该气体完全溶于水形成V L溶液(不考虑反应),所得溶液的物质的量浓度为________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com