
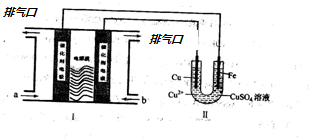
分析 (1)II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂;甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
(2)根据转移电子相等计算消失甲烷的体积;
(3)CuSO4是强酸弱碱盐水解呈酸性,反应方程式为:Cu2++2H2O?Cu(OH)2+2H+,加热CuSO4溶液,平衡正向移动,氢离子浓度增大,其酸性将增强;硫酸是不挥发的酸,所以加热蒸干CuSO4溶液所得固体为硫酸铜;
(4)结合2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,溶液中的Cu2+恰好完全析出计算反应后溶液的pH,电解硫酸铜溶液,要想恢复到与电解前的溶液相同,应加入CuO;
解答 解:(1)II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,所以a处通入的气体是甲烷;甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为CH4+10OH--8e-=CO32-+7H2O,
故答案为:CH4+10OH--8e-=CO32-+7H2O;
(2)串联电路中转移电子相等,所以消耗甲烷的体积=$\frac{\frac{2.56g}{64g/mol}×2}{8}×22.4L/mol$=224mL,故答案为:224;
(3)CuSO4是强酸弱碱盐水解呈酸性,反应方程式为:Cu2++2H2O?Cu(OH)2+2H+,加热CuSO4溶液,平衡正向移动,氢离子浓度增大,其酸性将增强;硫酸是不挥发的酸,所以加热蒸干CuSO4溶液所得固体为硫酸铜,故答案为:Cu2++2H2O?Cu(OH)2+2H+;增强;硫酸铜;
(4)溶液中的Cu2+恰好完全析出,则析出的n(Cu)=0.2L×0.05mol/L=0.01mol,则生成硫酸0.01mol,氢离子为0.02mol,c(H+)=$\frac{0.02mol}{0.2L}$=0.1mol/L,pH=1;电解硫酸铜溶液,溶液中的Cu2+恰好完全析出后,要想恢复到与电解前的溶液相同,应加入CuO,故答案为:1;C.
点评 本题考查学生电镀原理以及计算、原电池的构成条件、工作原理以及燃料电池的工作原理知识,注重基础知识的考查,难度不大.


科目:高中化学 来源: 题型:选择题
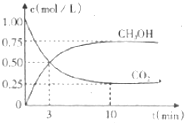 固定和利用C02.能存效地利用资源,并减少空气中的温室气体.工业上正在研究利用C02来生产甲醇燃料的方法,该方法的化学方程式是C02 (g)+3H2 (g)?CH30H (g)+H2O(g)△H=-49.0kJ/mol,在体积为1L的密闭容器中,充人1molCO2和4molH2,一定条件下发生反应:测得C02和CH30H(g)的浓度随时间变化如图所示.下列说法正确的是
固定和利用C02.能存效地利用资源,并减少空气中的温室气体.工业上正在研究利用C02来生产甲醇燃料的方法,该方法的化学方程式是C02 (g)+3H2 (g)?CH30H (g)+H2O(g)△H=-49.0kJ/mol,在体积为1L的密闭容器中,充人1molCO2和4molH2,一定条件下发生反应:测得C02和CH30H(g)的浓度随时间变化如图所示.下列说法正确的是| A. | 该反应在高温条件下能向发进行 | |
| B. | 充人 He(g).能使 $\frac{n(C{H}_{3}OH)}{n(C{0}_{2})}$增大 | |
| C. | 再充入1molCO2和4molH2,能使$\frac{n(C{H}_{2}OH)}{n(C{O}_{2})}$增大 | |
| D. | 容器内气体密度不再改变说明该飞应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
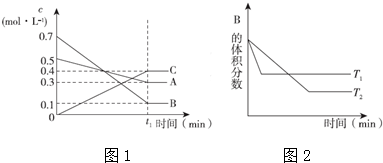
| A. | 该平衡体系的化学反应方程式为:3A(g)+B(g)═4 C(g) | |
| B. | 在t1时间内用B表示该反应的平均速率为0.6/t1mol•L-1•min-1 | |
| C. | 其他条件不变,升高温度,正反应速率减小、逆反应速率增大,A的转化率减小 | |
| D. | 维持温度和容器体积不变,往平衡体系中充惰性气体,C的百分含量增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.10mol•L-1Ag+ | B. | 0.20mol•L-1Zn2+ | C. | 0.20mol•L-1Cu2+ | D. | 0.20mol•L-1Pb2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液pH的大小顺序是②>① | |
| B. | 若将两种溶液稀释相同倍数,pH变化较大的是② | |
| C. | 若分别加入25mL0.1mol•L-1盐酸后,pH较大的是① | |
| D. | 若两种溶液的pH均为9,则物质的量浓度大小关系是①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L氯气与足量的钠反应,转移的电子数为2NA | |
| B. | 常温常压下,32gO3或O2中含有的氧原子数都为2NA | |
| C. | 1 mol氯气与足量水反应时,转移的电子数为2NA | |
| D. | 含2 mol H2SO4的浓硫酸与足量铜反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中 | |
| B. | 人们可以利用化学变化制造出新的分子和原子 | |
| C. | 门捷列夫提出的原子学说,为现代化学的发展奠定了坚实的基础 | |
| D. | 化学科学在未来还将继续推动材料科学的发展,使各种新功能材料的生产成为可能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com