
分析 白色沉淀7.5g为碳酸钙的质量,根据n=$\frac{m}{M}$计算碳酸钙的物质的量,根据碳原子守恒计算n(CO2),根据m=nM计算二氧化碳的质量,碱石灰增重9.3g为燃烧生成的二氧化碳与水,据此计算生成水的质量,利用原子守恒计算该气态烃的分子式,注意混合气体中两种烃体积分数相等这一条件,据此确定组成.
解答 解:(1)白色沉淀7.5g为碳酸钙的质量,故碳酸钙的物质的量=$\frac{7.5g}{100g/mol}$=0.075mol,n(CO2)=n(CaCO3)=0.075mol,m(CO2)=0.075mol×44g/mol=3.3g,碱石灰增重5.1g为燃烧生成的二氧化碳与水,故m(H2O)=5.1g-3.3g=1.8g,n(H2O)=0.1mol,则n(H)=n(H2O)×2=0.2mol,
n(C)=0.075mol,1.12L该气态烃的物质的量=$\frac{1.12L}{22.4L/mol}$=0.05mol,
故该烃中平均原子个数:N(C)=1.5、N(H)=4,所以一定含有甲烷,混合气体由两种烃等体积分数组成,所以另一种烃中氢个数也是4,碳个数只能是2,为乙烯,即混合气体由甲烷和乙烯组成.
答:混合气体由甲烷和乙烯组成.
点评 本题考查有机物分子式的确定,难度不大,注意掌握燃烧法利用守恒思想确定有机物分子组成方法,侧重对学生思维能力的考查.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | HOCH2COOCH2CH3 | B. | CH3CH(OH)CH2COOH | C. | HOCH2CH2CH2COOH | D. | CH3CH2CH(OH)COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 几种物质溶解度与温度的关系 | |||||
| 温度 | 0 | 10 | 20 | 30 | 40 |
| S(CaCl2)/g | 59.5 | 64.7 | 74.5 | 100 | 128 |
| S[Ca(ClO3)2]/g | 209 | ||||
| S(KClO3)/g | 3.3 | 5.2 | 7.3 | 10.2 | 13.9 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | |||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与钠反应放出氢气 | B. | 能与溴水发生加成反应 | ||
| C. | 能与溴水发生取代反应 | D. | 能发生加聚反应生成高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同时增大 | B. | 同时减小 | C. | 增大,减小 | D. | 减小,增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
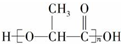 可在乳酸菌作用下完全降解,可代替聚苯乙烯制作一次性餐饮具,下列有关该材料的说法错误的是( )
可在乳酸菌作用下完全降解,可代替聚苯乙烯制作一次性餐饮具,下列有关该材料的说法错误的是( )| A. | 合成该材料的单体为 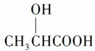 | |
| B. | 该合成材料的单体在氢氧化钠溶液作用下可形成环酯 | |
| C. | 合成该材料的方式与聚苯乙烯不同 | |
| D. | 该材料在一定条件下可发生水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com