
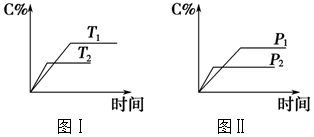
| A. | 化学方程式中m+n<e+f | |
| B. | 达平衡后,若升温,平衡左移 | |
| C. | 达平衡后,加入催化剂则C%增大 | |
| D. | 达平衡后,增加A的量有利于平衡向右移动 |
 字词句段篇系列答案
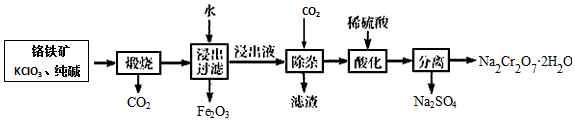
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 严禁露天焚烧农作物秸秆 | |
| B. | 加强植树造林,增大绿化面积 | |
| C. | 大力推行汽车使用天然气或氢气为燃料 | |
| D. | 生产生活中加大煤炭和石油等燃料的使用量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
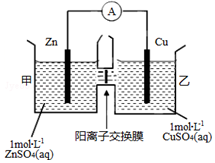 锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )
锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )| A. | 铜电极上发生氧化反应 | |
| B. | 外电路中电子由Cu流向Zn | |
| C. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| D. | 电池工作一段时间后,甲池的C(SO42-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 25.0 | 24.5 | 24.75 | 29.3 | 4.55 |
| 2 | 24.5 | 24.2 | 24.35 | 28.3 | 3.95 |
| 3 | 25.0 | 24.5 | 24.75 | 28.7 | 3.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 硫酸、盐酸、氢氟酸均为强酸 | D. | 氯水、水玻璃、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用钠可以检验某无水酒精中是否含有水 | |
| B. | 140℃时,无水乙醇与浓硫酸共热可制备乙烯 | |
| C. | 制取乙酸乙酯时,试剂加入的顺序是:先加入乙醇,后慢慢加入浓硫酸,最后加入乙酸 | |
| D. | 在蔗糖溶液中加入少量稀硫酸,水浴加热后,再加入少量新制的氢氧化铜悬浊液,加热至沸腾,没有砖红色沉淀生成,说明蔗糖没有水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com