
【题目】某气态烷烃和一气态烯烃组成的混合气体在同温、同压下对氢气的相对密度为13,取标准状况下此混合气体4.48L,通入足量的溴水,溴水质量增加2.8g,此两种烃的组成为(填分子式)
【答案】CH4 和C4H8
【解析】解:混合气态烃的平均相对分子质量为13×2=26,由于烯烃中乙烯的相对分子质量最小为28,故一定含有甲烷,
标况下4.48L混合气体的物质的量为 ![]() =0.2mol,故混合气体的总质量为0.2mol×26g/mol=5.2g,溴水质量增重2.8g为烯烃的质量,故甲烷的质量为5.2g﹣2.8g=2.4g,故甲烷的物质的量为
=0.2mol,故混合气体的总质量为0.2mol×26g/mol=5.2g,溴水质量增重2.8g为烯烃的质量,故甲烷的质量为5.2g﹣2.8g=2.4g,故甲烷的物质的量为 ![]() =0.15mol,烯烃的物质的量为0.2mol﹣0.15mol=0.05mol,烯烃的摩尔质量为
=0.15mol,烯烃的物质的量为0.2mol﹣0.15mol=0.05mol,烯烃的摩尔质量为 ![]() =56g/mol,令烯烃的组成为(CH2)n , 故14n=56,解得n=4,故该烯烃为C4H8 , 则两种烃的组成为CH4 和C4H8 , 所以答案是:CH4 和C4H8 .
=56g/mol,令烯烃的组成为(CH2)n , 故14n=56,解得n=4,故该烯烃为C4H8 , 则两种烃的组成为CH4 和C4H8 , 所以答案是:CH4 和C4H8 .


科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 溴水中有平衡:Br2+H2O![]() HBr+ HBrO加入 AgNO3溶液后,溶液颜色变浅
HBr+ HBrO加入 AgNO3溶液后,溶液颜色变浅
B. 对CO(g)+ NO2(g)![]() CO2(g)+NO(g)平衡体系增大压强可使颜色变深
CO2(g)+NO(g)平衡体系增大压强可使颜色变深
C. 升高温度能够增大硝酸钾在水中的溶解度
D. 合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)写出实验室制备氨气的化学方程式:______________________________ ;氨的水溶液显弱碱性,其原因为__________________________(用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”) ;若加入少量的明矾,溶液中的NH的浓度________(填“增大”或“减小”) 。
(2)硝酸铵加热分解可得到N2O和H2O。250 ℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为________________________________,平衡常数表达式为________;若有1 mol硝酸铵完全分解,转移的电子数为________mol。
(3)将pH=12的氨水和pH=2的盐酸等体积混合后溶液呈______性。
(4)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1 mol N2,其ΔH=________kJ·mol-1。
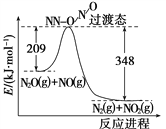
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法符合《食品卫生法》的是 ( )
A. 用SO2熏制银耳 B. 在奶粉中添加三聚氰胺
C. 用苏丹红做食品添加剂 D. 用小苏打作焙制糕点的发酵粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是___________;如果是多种成分,可能是__________。
(2)在上述所得溶液中,逐滴缓慢滴加2 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
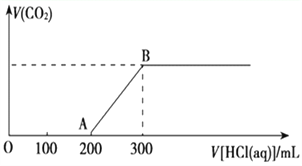
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式:_______。
②B点时,反应所得溶液中溶质的物质的量浓度是_________ (溶液体积的变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500 ℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和__________。
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。

① A中固体充分加热较长时间后,通入氮气,目的是__________________________。
②为验证A中残留物是否含有FeO,需要选用的试剂有____________(填字母)。
A.KSCN溶液 B.稀硫酸
C.浓盐酸 D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有________气体生成,若含有该气体,观察到的现象为_______________________________________。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为b mol,C中沉淀物质的量为a mol,则b________________(填“大于”“小于”或“等于”)a。
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为___________________________________________(用离子方程式表示)。
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O的含量,某实验小组做了如下实验:
测定原理:MnO![]() +Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
+Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
测定步骤:步骤一:准确称量20.00 g硫酸亚铁铵晶体,配制成100 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,用0.100 0 mol·L-1 KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00 mL。
①如何判断滴定终点?________________________;
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知An+、B(n-1)+、C(n+1)+、D(n+1)-都有相同的电子层结构,A、B、C、D的原子半径由小到大的顺序是( )
A. C>D>B>A B. D >C> A>B C. B>A>C>D D. A>B>D>C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com