
【题目】下列说法和解释错误的是
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物![]() 从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】将一定量的Fe、Fe2O3和CuO的混合物,放入体积为100 mL物质的量浓度为2.2 mol/L的H2SO4溶液中,充分反应后,生成气体896mL(标准状况),得到不溶固体1.28 g。过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为100mL)。向滤液中加入2 mol/L NaOH溶液至40mL时开始出现沉淀。则未滴加NaOH溶液前滤液中FeSO4的物质的量浓度为
A. 1.8 mol/LB. 2 mol/LC. 2.2 mol/LD. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修5:有机化学基础]
氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
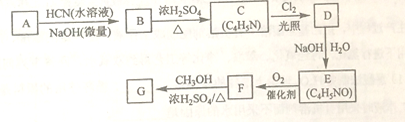
已知:
①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②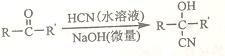
回答下列问题:
(1)A的化学名称为_______。
(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。
(3)由C生成D的反应类型为________。
(4)由D生成E的化学方程式为___________。
(5)G中的官能团有___、 ____ 、_____。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】布洛芬是一种抗炎、镇痛、解热的常用药,其部分合成路线如下。
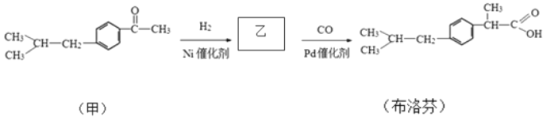
请回答:
(1)乙的结构简式是________________。
(2)布洛芬中含氧官能团的名称是_____________________。
(3)甲 ![]() 乙的反应类型是____________。
乙的反应类型是____________。
(4)布洛芬乙酯是布洛芬粗品精制过程中产生的一种杂质。布洛芬与乙醇,在酸性条件下会生成布洛芬乙酯,该反应的化学方程式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中M为非金属元素![]() 下列说法正确的是
下列说法正确的是
![]()
A. M的最高价氧化物为一种酸酐
B. Z的离子半径是同周期各简单离子中最小的
C. X的气态氢化物的稳定性比Y的强
D. Z的氢化物酸性是同族中最强的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Co、Ni的化合物在生产生活中有着广泛的应用。
(1)![]() 元素在周期表中的位置是4周期,_________族。基态Co原子的电子排布式为____________。
元素在周期表中的位置是4周期,_________族。基态Co原子的电子排布式为____________。
(2)乙二胺NH2-CH2-CH2-NH2(缩写符号en)中N原子的杂化方式为________杂化。en可以与Co形成配合物[Co(en)2Cl2]Cl·HCl·2H2O,配离子结构如下图所示,中心离子的配位数为________,配合物晶体中可能存在的作用力有___________。
A、离子键 B、极性共价键 C、非极性共价键 D、配位键 E、氢键

(3)NiO晶体结构如图1所示,其中离子坐标参数A为(0,0,0),B为(![]() ),则C离子(面心处)坐标参数为_______________。
),则C离子(面心处)坐标参数为_______________。

(4)天然氧化镍晶体中总是存在晶体缺陷,如图2所示。NiXO晶体中x值为![]() ,若晶体中的Ni分别为
,若晶体中的Ni分别为![]() 、
、![]() ,此晶体中
,此晶体中![]() 与
与![]() 的最简整数比为______。
的最简整数比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A. 在稀溶液中,H2SO4和Ba(OH)2的中和热要大于57.3kJ/mol
B. 2C(s)+O2(g)═2CO(g)△H <O,△S>O
C. 已知:2SO2(g) +O2(g)![]() 2SO3 (g) ;△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
2SO3 (g) ;△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
D. 在10lkPa、25℃时,1gH2完全燃烧生成气态水,放出120.9kJ的热量,则氢气的燃烧热为241.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据右边反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。工业上制取漂白粉的反应也在其中。
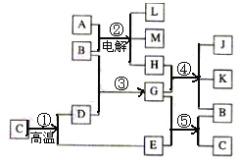
(1)单质L是_____ 。
(2)化合物B是____。
(3)图中除反应①以外,还有两个用于工业生产的反应,是________和_______(填代号)。
请写出他们的化学反应方程式:____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究溶液酸碱性对![]() 溶液的配制和保存的影响。10mL
溶液的配制和保存的影响。10mL![]() 或10mL
或10mL![]() 溶液中。
溶液中。
I.![]() 溶液的配制
溶液的配制
将![]() 分别溶于10mL蒸馏水或10mL
分别溶于10mL蒸馏水或10mL
溶液编号 | 溶剂 | 溶液性状 | |
① | 蒸馏水 | 浅黄色澄清溶液: | 遇 |
② |
| 无色澄清溶液: | 遇 |
③ |
| 无色澄清溶液 | 遇 |
(1)用平衡移动原理解释①显酸性的主要原因是________________
(2)②、③变红发生反应的离子方程式是_______________________
(3)甲同学认为①中一定有+3价铁。他用激光笔照射“溶液”,观察到光路:又向含有KSCN的①中滴入试剂a,溶液变红,说明其推断正确,试剂a是____________
II ![]() 溶液的保存
溶液的保存
将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
溶液编号 | 溶液性状 | |
① | 橙色浑浊 | 用 |
② | 无色溶液 | 滴加5滴 |
③ | 无色溶液 | 滴加5滴 |
(分析讨论)①②说明酸性减弱时,![]() 溶液更易变质;②③说明……
溶液更易变质;②③说明……
(查阅资料)在一定pH范围内,+2价铁的还原性随酸性减弱而增强,氧气的氧化性随酸性的增强而增强。
(进行实验)用右图所示装置完成实验(滴加试剂时溶液体积和溶液导电性变化可忽略)。向右池持续稳定通人氧气,待电流表示数稳定后:
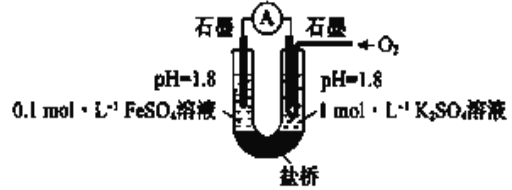
I 向左池滴加浓硫酸至![]() 接近
接近![]() ,电流没有明显变化
,电流没有明显变化
II 向右池滴加等量浓硫酸,电流明显增大。
(4)补全(分析讨论):②③说明_______________
(5)ii中右池的电极反应方程式是____________________
(6)依据实验推断:③比②中![]() 更易变质的原因是___________________
更易变质的原因是___________________
(7)按上述原理及装置重新进行实验证实①中![]() 更易变质的原因。实验方案及预期现象是:向右池持续稳定通人氧气,待电流计示数稳定后,____________
更易变质的原因。实验方案及预期现象是:向右池持续稳定通人氧气,待电流计示数稳定后,____________
(8)依据实验,配制并保存![]() 溶液的最佳法是_________________。
溶液的最佳法是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com