
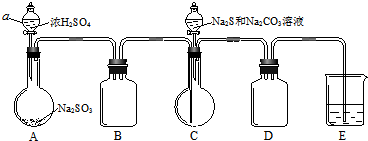
 ClO2作为一种广谱型的消毒剂,其有效氯是氯气的2.6倍.如图是实验室用于制备ClO2并检验其部分性质的装置(某些夹持装置省略).
ClO2作为一种广谱型的消毒剂,其有效氯是氯气的2.6倍.如图是实验室用于制备ClO2并检验其部分性质的装置(某些夹持装置省略).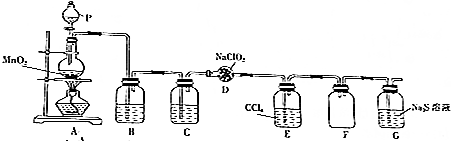
分析 由题目中所给信息和实验装置图可知:本实验首先用浓盐酸和MnO2在加热条件下反应制备Cl2,反应的方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,经装置B中饱和食盐水吸收氯化氢除杂、通过装置C中的浓硫酸干燥后,在D中与亚氯酸钠固体反应生成ClO2,由于Cl2易溶于CCl4液体,ClO2是一种易溶于水、难溶于有机溶剂的气体,E用于除去ClO2中的未反应的Cl2,F装置是安全瓶防止G中溶液倒吸,最后尾气吸收,
(1)实验室用浓盐酸和MnO2在加热条件下反应制备Cl2,浓盐酸应盛装在分液漏斗中,则P为分液漏斗;
(2)浓盐酸和MnO2在加热条件下反应制备Cl2;
(3)F为安全瓶防止倒吸;由于Cl2易溶于CCl4液体,ClO2是一种易溶于水、难溶于有机溶剂的气体,E用于除去ClO2中的未反应的Cl2;
(4)反应结束后,取G中溶液分别滴入AgNO3溶液和BaCl2溶液中,均产生不溶于稀硝酸的沉淀,说明生成产物中含有氯离子、硫酸根离子,结合原子守恒、电子守恒、电荷守恒配平书写离子方程式;
(5)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性.
解答 解:(1)装置中仪器图形分析可知P为分液漏斗,故答案为:分液漏斗;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)F导气管略露出胶塞为安全瓶防止倒吸;由于Cl2易溶于CCl4液体,ClO2是一种易溶于水、难溶于有机溶剂的气体,E用于除去ClO2中的未反应的Cl2,
故答案为:防止倒吸;除去ClO2中的未反应的Cl2;
(4)反应结束后,取G中溶液分别滴入AgNO3溶液和BaCl2溶液中,均产生不溶于稀硝酸的沉淀,说明生成产物中含有氯离子、硫酸根离子,结合原子守恒、电子守恒、电荷守恒配平书写离子方程式为:8ClO2+5S2-+4H2O=5SO42-+8H++8Cl-,
故答案为:8ClO2+5S2-+4H2O=5SO42-+8H++8Cl-;
(5)装置G的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,干燥氯气的试剂不能选液体,选择固体干燥剂,碱石灰会反应,所以选无水氯化钙,Ⅰ、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,
故答案为:bea.
点评 本题考查了实验室制备氯气装置、除杂、气体性质和实验验证,氧化还原反应分析等知识点,掌握基础是解题关键,题目难度中等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
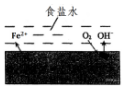 在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现.铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图.下列说法正确的是( )
在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现.铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图.下列说法正确的是( )| A. | 铁片发生还原反应而被腐蚀 | |
| B. | 此过程中电子从C移向Fe | |
| C. | 铁片腐蚀中负极发生的电极反应:2H2O+O2+4e-═4OH- | |
| D. | 铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
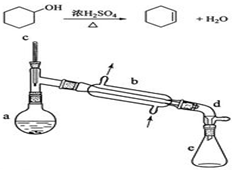 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
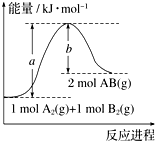 图象法是研究化学反应的焓变的一种常用方法.已知化学反应A2(g)+B2(g)═2AB(g)的能量变化曲线如图所示,则下列叙述中正确的是( )
图象法是研究化学反应的焓变的一种常用方法.已知化学反应A2(g)+B2(g)═2AB(g)的能量变化曲线如图所示,则下列叙述中正确的是( )| A. | 每生成2 mol AB时吸收(a-b) kJ能量 | |
| B. | 该反应热△H=+(a-b) kJ•mol-1 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 断裂1 mol A-A和1 mol B-B键时放出a kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用可见光束可以鉴别红褐色的氢氧化铁胶体和溴水,是因为溶液与胶体的本质区别是能否发生丁达尔效应 | |
| B. | 分散系是一种物质分散到另一种物质中形成的混合体系 | |
| C. | 氢氧化铁胶体具有吸附性,能吸附水中悬浮颗粒并沉降,因而常用于净水 | |
| D. | 淀粉溶液和蛋白质溶液是溶液,不可能是胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com