
 =0.05mol,若只生成NO,根据电子转移守恒可知,n(NO)=
=0.05mol,若只生成NO,根据电子转移守恒可知,n(NO)= =0.05mol,则V(NO)=0.05mol×22.4L/mol=1.12L;计算生成NO的体积;若只生成NO2,根据电子转移守恒可知,n(NO2)=
=0.05mol,则V(NO)=0.05mol×22.4L/mol=1.12L;计算生成NO的体积;若只生成NO2,根据电子转移守恒可知,n(NO2)= =0.15mol,V(NO2)=0.15mol×22.4L/mol=3.36L,由于实际生成气体1.12L,故只生成NO,故B错误;
=0.15mol,V(NO2)=0.15mol×22.4L/mol=3.36L,由于实际生成气体1.12L,故只生成NO,故B错误;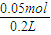 =0.25mol/L,反应后溶液pH为1,所以c(H+)=0.1mol/L,所以c(NO3-)=0.25mol/L×3+0.1mol/L=0.85mol/L,故C正确;
=0.25mol/L,反应后溶液pH为1,所以c(H+)=0.1mol/L,所以c(NO3-)=0.25mol/L×3+0.1mol/L=0.85mol/L,故C正确; ×0.22mol,质量为
×0.22mol,质量为 ×0.22mol×56g/mol=4.62g,故还能溶解铁4.64g-2.8g=1.82g,故D正确.
×0.22mol×56g/mol=4.62g,故还能溶解铁4.64g-2.8g=1.82g,故D正确.

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
2.8gFe全部溶于一定浓度、200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
A.反应后溶液中铁元素一定只以Fe3+ 形式存在
B.1.12L气体可能是NO、NO2的混合气体
C.反应后溶液中c(NO3-)=0.85mol/L
D.反应后的溶液最多还能溶解1.4gFe
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应后溶液中铁元素一定只以Fe3+形式存在 |
| B.1.12L气体可能是NO、NO2的混合气体 |
| C.反应后溶液中c(NO3-)=0.85mol/L |
| D.反应后的溶液最多还能溶解1.82gFe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com