
25℃时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是( )
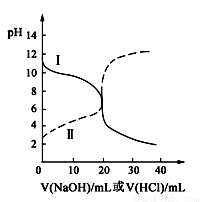
A.曲线Ⅰ:滴加溶液到10 mL时:
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.曲线Ⅰ:滴加溶液到20 mL时:
c(Cl-)=c(NH4+)>c(H+)=c(OH-)
C.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:
c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线Ⅱ:滴加溶液到10 mL时:
c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
科目:高中化学 来源:2017届新疆生产建设兵团二中高三上第一次月考化学试卷(解析版) 题型:选择题
在强酸性溶液中能大量共存,且溶液为无色透明的离子组是( )
A.Na+、A13+、SO42-、NO3- B.Ba2+、Na+、SO42-、NO3-
C.K+、Mg2+、MnO4-、SO42- D.K+、Na+、NO3-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
根据下表信息,判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
元素代号 | G | L | M | Q | R | T |
原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
主要化合价 | +1 | +2 | +3 | +6、﹣2 | +5、﹣3 | ﹣2 |
A.单质的还原性:G<L<M B.非金属性:T<Q
C.气态氢化物的稳定性:R>T D.L2+与T2﹣的核外电子数相等
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第一次周练化学试卷(解析版) 题型:实验题
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β?锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
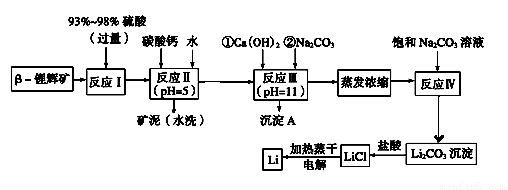
已知:
①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
请回答下列问题:
(1)用氧化物形式表示LiA lSi2O6的组成:_______________________
lSi2O6的组成:_______________________
(2)反应Ⅱ加入碳酸钙的作用是____________________
(3)写出反应Ⅲ中生成沉淀A的离子方程式:____________________
(4)洗涤所得Li2CO3沉淀要使用“热水”还是“冷水”理由是____________________
(5)流程中两次使用了Na2CO3溶液,第一次浓度小,第二次浓度大的原因是____________________
(6)该工艺中,电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是____________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省淄博市高二上学期开学测化学试卷(解析版) 题型:填空题
右图为部分元素在元素周期表中的相对位置。据此回答相关问题:

(1)其中非金属性最强的是 (填元素符号)。
(2)N、P两种元素的最高价氧化物对应的水化物的酸性:HNO3 H3PO4(填“>”、“=”或“<”)。
(3)O位于元素周期表中的第 族。
(4)S、Cl两种元素氢化物的稳定性:H2S HCl(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省淄博市高二上学期开学测化学试卷(解析版) 题型:选择题
下列选用的试剂能达到对应实验目的的是
| 实验目的 | 选用试剂 |
A | 检验FeCl2溶液是否变质 | KSCN溶液 |
B | 除去氨气中的水蒸气 | 浓H2SO4 |
C | 除去乙酸乙酯中的乙酸 | NaOH溶液 |
D | 除去二氧化碳中少量的氯化氢气体 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省葫芦岛市六校协作体高二上期初考试化学卷(解析版) 题型:选择题
某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+ 和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
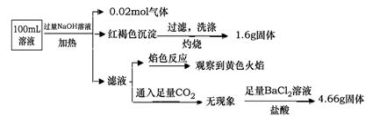
由此可知原溶液中( )
A.原溶液中c(Fe3+)=0.2 mol·L-1
B.溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol·L-1
C.SO42ˉ、NH4+ 、Na+一定存在,CO32ˉ、Al3+一定不存在
D.要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入足量酸性高锰酸钾溶液,若溶液紫红色褪去,则证明原溶液中有Fe2+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上9月月考化学试卷(解析版) 题型:选择题
一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g) C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是 ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量④B物质的量浓度⑤混合气体的摩尔质量
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是 ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量④B物质的量浓度⑤混合气体的摩尔质量
A.①④⑤ B.②③ C.②③④ D.只有④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com