
【题目】在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度。
(1)若将W g Na2C2O4配成100mL标准溶液,移取20.00mL置于锥形瓶中,则酸性KMnO4溶液应装在______(填“酸式”或“碱式”)滴定管中,判断滴定达到终点的现象是_________________。
(2)写出KMnO4与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2的化学方程式:________________________。
(3)25℃时,用pH计测得0.10 mol·L-1草酸钠溶液的pH=a,则H2C2O4的第二级电离平衡常数Ka2= 。
(4)CaC2O4是难溶于水的固体,受热易分解,在一定温度下向2L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应: CaC2O4(s)![]() CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为16.8g,则该段时间内υ(CO)=__________mol·L-1·s-1;当反应达到平衡后,将容器体积压缩到原来的一半,则下列说法正确的是__________(填答案选项编号)。
CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为16.8g,则该段时间内υ(CO)=__________mol·L-1·s-1;当反应达到平衡后,将容器体积压缩到原来的一半,则下列说法正确的是__________(填答案选项编号)。
A.平衡不移动,CaO的质量不变
B.平衡发生移动,当CO的百分含量不变时达到新的平衡
C.平衡发生移动,但CO和CO2的浓度都没有改变
D.平衡向逆反应方向移动,且该反应的化学平衡常数减小
【答案】(1)酸式;滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色;
(2)2KMnO4+8H2SO4+5Na2C2O4=K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O;
(3)10(13-2a);(4)①5×10-4;C。
【解析】
试题分析:(1)高锰酸钾溶液显强氧化性,应用酸式滴定管盛放,用高锰酸钾溶液滴定Na2C2O4,因此滴定终点:滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色;(2) KMnO4作氧化剂,+7价→+2价,化合价降低5价,C2O42-由+3价→+4价,化合价共升高2价,最小公倍数为10,因此化学反应方程式为:2KMnO4+8H2SO4+5Na2C2O4=K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O;(3)C2O42-+H2O![]() HC2O42-+OH-,HC2O4-
HC2O42-+OH-,HC2O4-![]() H++C2O42-,K=c(H+)×c(C2O42-)/c(HC2O4-)=10-a×0.1/10(a-14)= 10(13-2a);(4)①生成CO的物质的量为16.8/56mol=0.3mol,根据化学反应速率的表达式,v(CO)=0.3/(2×5×60)mol/(L·s)=5×10-4 mol/(L·s),A、容积压缩,压强增大,根据勒夏特列原理,平衡向逆反应方向移动,CaO的质量减少,故错误;B、根据化学平衡常数表达式,K=c(CO)×c(CO2),化学平衡常数只受温度的影响,温度不变,则化学平衡常数不变,压缩气体,CO的百分含量不变,故错误;C、根据选项B的分析,故正确;D、化学平衡常数只受温度的影响,温度不变,化学平衡常数不变,故错误。
H++C2O42-,K=c(H+)×c(C2O42-)/c(HC2O4-)=10-a×0.1/10(a-14)= 10(13-2a);(4)①生成CO的物质的量为16.8/56mol=0.3mol,根据化学反应速率的表达式,v(CO)=0.3/(2×5×60)mol/(L·s)=5×10-4 mol/(L·s),A、容积压缩,压强增大,根据勒夏特列原理,平衡向逆反应方向移动,CaO的质量减少,故错误;B、根据化学平衡常数表达式,K=c(CO)×c(CO2),化学平衡常数只受温度的影响,温度不变,则化学平衡常数不变,压缩气体,CO的百分含量不变,故错误;C、根据选项B的分析,故正确;D、化学平衡常数只受温度的影响,温度不变,化学平衡常数不变,故错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有下列十种物质:① 液态氯化氢 ②小苏打③ 固体纯碱 ④ 二氧化碳 ⑤蔗糖 ⑥ 氢氧化钾 ⑦氢氧化铁胶体 ⑧ 氨水 ⑨空气 ⑩ 硫酸铁溶液
(1)上述十种物质中,属于电解质的有_________,属于非电解质的有_____________。
(2)有两种物质在水溶液中可发生反应,离子方程式为H++OH-=H2O,该反应的化学方程式为_______。
(3)除去③中少量②的操作是________,化学方程式为_____________。
(4)标准状况下,_________L④中含有0.4mol氧原子。
(5)现有100mL⑩溶液中含Fe3+5.6g,则溶液中SO42-的物质的量浓度是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的变化过程中有共价键明显被破坏的是( )
①I2升华 ②氯化钠溶于水 ③氯化氢溶于水 ④碳酸氢铵中闻到了刺激性气味
A. ①② B. ①③ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于SO2的说法中,不正确的是( )
A. SO2是酸性氧化物
B. SO2是形成酸雨的主要污染物之一
C. SO2与水反应生成H2SO4
D. 高温下SO2可被催化氧化生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙两同学分别对含+4价硫元素的物质性质进行了探究。
(1)甲用下图装置进行实验(气密性已检验,加热和夹持装置已略去)。实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4。
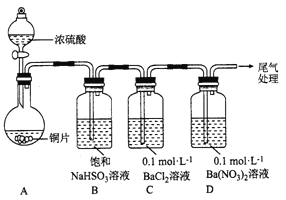
① A中反应的化学方程式是______________。
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现由色沉淀的过程中,D溶液中NO3-浓度几乎不变。甲据此得出结论:D中出现白色沉淀的主要原因是__________________。
(2)乙用如下实验对含+4价疏元素的物质性质继续进行探究。
序兮 | 实验搡作 | 实聆现象 |
1 | 取0.3g纯净Na2SO3固体,向其中加人10mL 2 mol/L盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡,滴入BaCl2溶液后,开始无现象,4 min后,溶液变浑浊 |
2 | 取0.3g纯净Na2SO3固体,向其中加入10mL 2 mol/L HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2 h后,溶液变浑浊 |
3 | 取0.3g纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
①用离子方程式解释实验1中产生现象的原因:________________。
② 由实验1、2、3对比,可以得到推论:________________。
③乙通过査阅资料发现.Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和 NO3-对其的影响:
序号 | 实验操作 | 实验现象 |
4 | 取____固体混合物,向其中加入10mL2 mol /LHNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;:滴入BaCl2溶液后,开始无现象,20 min后,溶液变浑浊 |
i.实验2和4对比,乙获得推论:C1-的存在可以加快溶液中+4价硫元索的氧化;
ii.实验I和4对比,乙获得推论: ______________。
④通过以上实验,乙同学认为,确定某溶液中含有SO42-的实验方案:取待测液,向其中先滴加____________ (填字母序号)。
a.2 mol/L盐酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
B.2 mol/L盐酸,再滴加BaCl2溶液,立即出现白色沉淀
C.2 mol/L硝酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
D.2 mol/L硝酸,再滴加BaCl2溶液,立即出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一碘水和Fe(OH)3胶体的颜色极为相似。不用化学方法将它们区别开来,这样的方法有( )
①丁达尔效应 ②加热法 ③电泳实验法 ④加电解质法
A. ②④ B. ③④ C. ②③④ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com