
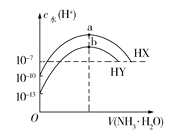
【题目】25℃时,分别向浓度均为0.1 mol/L,体积均为20 mL的HX和HY的溶液中滴入等物质的量浓度的氨水,溶液中水电离出的c(H+)与加入氨水的体积变化关系如图所示。下列说法正确的是
A. HX的电离方程式为HX![]() H++X
H++X
B. b点时溶液中c(![]() )=c(Y)>c(H+)=c(OH)
)=c(Y)>c(H+)=c(OH)
C. HX的电离平衡常数约为1×107 mol/L
D. a、b两点对应溶液中存在的微粒种类数目相同
【答案】C
【解析】由图中看出0.1 mol/L的HY溶液中,由水电离出的c(H+)=1×1013 mol/L,可知HY为强酸,HX为弱酸,其电离方程式为HX![]() H++X,A错误;b点时水的电离程度最大,说明NH3·H2O和HY恰好反应,溶质为NH4Y,由于
H++X,A错误;b点时水的电离程度最大,说明NH3·H2O和HY恰好反应,溶质为NH4Y,由于![]() 的水解溶液显酸性,故c(Y)>c(
的水解溶液显酸性,故c(Y)>c(![]() )>c(H+)>c(OH),B错误;HX溶液中由HX电离出的c(H+)=1×104 mol/L,则其电离平衡常数K=
)>c(H+)>c(OH),B错误;HX溶液中由HX电离出的c(H+)=1×104 mol/L,则其电离平衡常数K=![]() ≈
≈![]() =1×107 mol/L,C正确;a点溶质为NH4X,但由于
=1×107 mol/L,C正确;a点溶质为NH4X,但由于![]() 和X均水解,溶液中存在
和X均水解,溶液中存在![]() 、NH3·H2O、X、HX、H+、OH和H2O共7种微粒;b点溶质为NH4Y,只有
、NH3·H2O、X、HX、H+、OH和H2O共7种微粒;b点溶质为NH4Y,只有![]() 水解,溶液中存在
水解,溶液中存在![]() 、NH3·H2O、Y、H+、OH和H2O共6种微粒,D错误
、NH3·H2O、Y、H+、OH和H2O共6种微粒,D错误


科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W为常见的主族元素,根据下表信息回答问题:
元素 | 元素性质或原子结构信息 |
X | 短周期元素原子半径最大(稀有气体元素不参与比较) |
Y | +3价阳离子的核外电子排布与氖原子相同 |
Z | 原子核外M电子层与K电子层的电子数相等 |
R | 与Z同周期,主要化合价为1、+7 |
W | 原子结构示意图: |
(1)写出元素X的原子结构示意图_____;元素W在周期表中位置_____。
(2)Y、Z最高价氧化物对应水化物的碱性强弱比较_____>_____(填化学式)。
(3)用电子式表示X和R形成化合物的过程:_____。
(4)下列对于W及其化合物的推断中,正确的是_____(填序号)。
①W的最低负化合价与R的最低负化合价相同
②W的氢化物的稳定性弱于R的氢化物的稳定性
③W的单质可与X和R形成的化合物的水溶液发生置换反应
④W的最高价氧化物对应水化物的酸性比R的强
(5)为验证卤族部分元素单质氧化性的递变规律,设计如图装置进行实验,请回答:
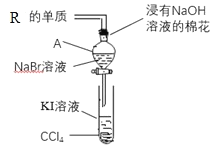
①A中发生的反应的离子方程式是_____。
②棉花中浸有的NaOH溶液的作用是_____(用离子方程式表示)。
③为验证Br2与I2的氧化性强弱:通入一定量R的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到_____。该实验必须控制加入的R单质的量,否则得不出Br2的氧化性比I2强。理由是______。
④从原子结构的角度解释卤族元素单质氧化性逐渐减弱的原因:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素![]() 、
、![]() 、
、![]() 、
、![]() 原子序数依次增大,
原子序数依次增大,![]() 与
与![]() 同主族但最高化合价不同,
同主族但最高化合价不同,![]() 是金属性最强的短周期元素。下列说法不正确的是( )。
是金属性最强的短周期元素。下列说法不正确的是( )。
A.简单离子半径:![]()
B.最高价氧化物对应水化物的酸性:![]()
C.化合物![]() 能与水剧烈反应,产生白雾并放出具有刺激性气味的气体
能与水剧烈反应,产生白雾并放出具有刺激性气味的气体
D.![]() 的气态氢化物通入
的气态氢化物通入![]() 水溶液中产生淡黄色沉淀并放出有刺激性气味的气体
水溶液中产生淡黄色沉淀并放出有刺激性气味的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知海水中的溴含量约为65mg·L-1,从海水中提取溴的工业流程如图:
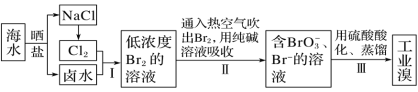
(1)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是_____。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的______(填字母)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在方框内填入正确的化学计量数,并将配平后的反应写在答题纸相应位置。_____
![]()
(4)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为_____。
(5)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有______(填字母)。
A.乙醇 B.四氯化碳 C.裂化汽油 D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动汽车已逐渐走入人们的生活,一些电动汽车动力使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A极材料是金属锂和石墨的复合材料(石墨作为金属锂的载体),电解质为一种能传导Li+的高分子材料。隔膜只允许特定的离子通过,电池反应式为LixC6+Li1xCoO2![]() C6+LiCoO2,下列说法不正确的是
C6+LiCoO2,下列说法不正确的是
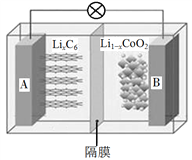
A. 该隔膜只允许Li+通过,放电时Li+从左边移向右边
B. 充电时,B电极与电源正极相连
C. 电池放电时,负极的电极反应式为LixC6xe![]() xLi++C6
xLi++C6
D. 废旧钴酸锂电池进行“放电处理”让Li+进入石墨中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
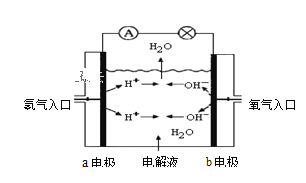
【题目】Ⅰ.下图为氢氧燃料电池原理示意图,按下图的提示,回答以下问题:
(1)若电解质溶液为KOH溶液,则写出电极反应式:![]() 极 ____________,
极 ____________,![]() 极 _______________。
极 _______________。
(2)若电解质溶液为稀H2SO4,则写出电极反应式:![]() 极 _____________,
极 _____________,![]() 极 _______________。
极 _______________。
Ⅱ.氨基甲酸铵分解反应为NH2COONH4(s) ![]() 2NH3(g)+CO2(g),在体积不变的密闭容器中发生反应,可以判断该反应已经达到平衡的是__________。
2NH3(g)+CO2(g),在体积不变的密闭容器中发生反应,可以判断该反应已经达到平衡的是__________。
A.密闭容器中氨气的体积分数不变 B.1molNH2COONH4分解同时有44gCO2消耗
C.密闭容器中混合气体的密度不变 D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如图所示:
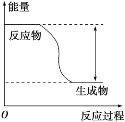
(1)该反应为_____(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率加快,下列措施可行的是_____(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_____(填“正”或“负”)极。铜片上的现象为_____,该极上发生的电极反应为_____,外电路中电子由_____移动。(填“正极向负极”或“负极向正极”)
查看答案和解析>>
科目:高中化学 来源: 题型:
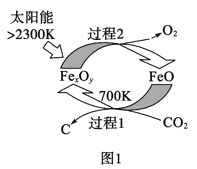
【题目】二氧化碳的利用是我国能源领域的一个重要战略方向,目前我国科学家在以下方面已经取得重大成果。
(1)图1是由CO2制取C的太阳能工艺。已知过程1发生的反应中![]() =6,则FexOy的化学式为__。过程1生成1molC的反应热为△H1;过程2产生lmolO2(g)的反应热为△H2。则由CO2制取C的热化学方程式为__。
=6,则FexOy的化学式为__。过程1生成1molC的反应热为△H1;过程2产生lmolO2(g)的反应热为△H2。则由CO2制取C的热化学方程式为__。
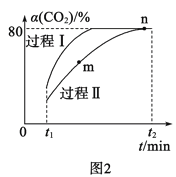
(2)利用CO2合成甲醇的反应为:CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=-53.7kJ·mol-1,一定条件下,将1molCO2和2.8molH2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图2所示。过程Ⅰ的活化能__(填“>”“<”或“=”)过程Ⅱ的活化能,n点的平衡常数K=__。
H2O(g)+CH3OH(g) ΔH=-53.7kJ·mol-1,一定条件下,将1molCO2和2.8molH2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图2所示。过程Ⅰ的活化能__(填“>”“<”或“=”)过程Ⅱ的活化能,n点的平衡常数K=__。
(3)用二氧化碳合成低密度聚乙烯(LDPE)。以纳米二氧化钛膜为工作电极,常温常压电解CO2,可制得LDPE,该电极反应可能的机理如图3所示。
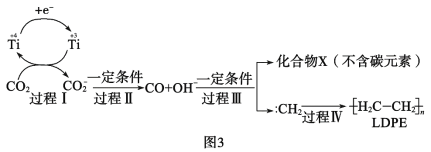
①过程Ⅰ~Ⅲ中碳元素发生__反应(填“氧化”或“还原”)。
②请补充完整并配平CO2转化为LDPE的电极反应:2nCO2+___+___=![]() +___。__
+___。__
③工业上生产1.4×104g的LDPE,理论上需要标准状况下CO2的体积是__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.氨水中通入过量的SO2:2NH3·H2O + SO2 = 2NH4+ + SO32-+H2O
B.大理石与醋酸反应:CaCO3+2H+ =Ca2+ + H2O + CO2↑
C.向热的稀硫酸中加入铜粉并鼓入空气:2Cu+4H++O2![]() 2Cu2++2H2O
2Cu2++2H2O
D.碳酸氢钠溶液和过量氢氧化钡溶液混合:2HCO3-+ Ba2+ + 2OH-== BaCO3↓+ CO32- + 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com