
【题目】在某无色透明酸性溶液,能够共存的离子组是( )
A.Al3+、NH4+、NO3﹣、Cl﹣B.Br﹣、Fe2+、Fe3+、SO42﹣
C.Na+、SO32﹣、K+、NO3﹣D.K+、Na+、I ﹣、CO32﹣
科目:高中化学 来源: 题型:
【题目】某学习小组为研究电化学原理,设计如图装置。请回答下列问题:
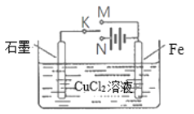
(1)若K与M、N均断开,发生的离子反应为____________________。
(2)若K与M相连、与N断开,石墨为_________(填电极名称)。
(3)若K与N相连、与M断开,石墨电极处的现象为____________________。
(4)若将CuCl2溶液换成精制饱和食盐水,仍保持K与N相连、与M断开,此时装置中发生的离子反应方程式为_______________________________。若此反应过程中转移1mol电子,理论上共产生标准状况下气体__________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度(t ℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw=______。在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,若所得混合液为中性,且a+b=12,则Va∶Vb=________。
(2)25 ℃时,0.1 mol·L-1的HA溶液中![]() =1010。请回答下列问题:
=1010。请回答下列问题:
①HA是________(填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是__________(填字母)。
a.c(HA) b.![]() c.c(H+)与c(OH-)的乘积 d.c(OH-)
c.c(H+)与c(OH-)的乘积 d.c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠的说法正确的是( )
A. 钠是银白色金属、密度比水略大 B. 钠着火时,可用水灭火
C. 金属钠在空气中燃烧,生成氧化钠 D. 通常情况下,钠的熔点略低于水的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2X(g) + Y(g) ![]() 3Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
3Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
(1)升高温度:____________;
(2)增大压强:____________;
(3)增大容器容积:______________;
(4)加入 X :______________;
(5)加入 Y :______________;
(6)压缩体积:______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1) 在 25℃、 101kPa 下,1g液态乙醇燃烧生成 CO2 和液态水时放热 29.7 kJ。则表示乙醇燃烧热的热化学方程式为_____________________________。
(2)已知拆开1mol H-H键,1mol N-H 键,1mol N≡N 键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2 反应生成NH3 的热化学方程式为____________________________ 。
(3)① P4(白磷,s) + 5O2(g)= P4O10(s) ΔH = -2983.2 kJ/mol② P(红磷,s) + 5/4O2(g)= 1/4 P4O10(s)ΔH = -738.5 kJ/mol,则白磷转化为红磷的热化学方程式为___________________。相同状况下,能量较低的是_____________。
(4)③C(s)+ ![]() O2(g) = CO(g) ΔH = -110.5 kJ·mol-1,④ C(s) + O2(g) = CO2(g) ΔH = -393.5 kJ·mol-1,则燃烧36g C(s)生成CO2,放出的热量为____。写出CO燃烧的热化学方程式__________。
O2(g) = CO(g) ΔH = -110.5 kJ·mol-1,④ C(s) + O2(g) = CO2(g) ΔH = -393.5 kJ·mol-1,则燃烧36g C(s)生成CO2,放出的热量为____。写出CO燃烧的热化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe@Fe2O3纳米线是一种新型铁基材料,在催化、生物医药、环境科学等领域具有广阔应用前景。某研究小组以赤泥(铝土矿提取氧化铝过程中产生的固体废弃物,含SiO2、Fe2O3、Al2O3)为原料,设计下列流程制备Fe@Fe2O3纳米线并探究其在水处理中的应用。
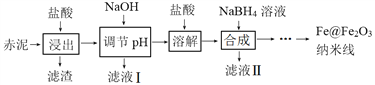
回答下列问题:
(1)“浸出”实验中,盐酸起始浓度对铁、铝浸出率的影响如图所示:
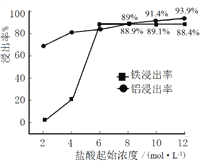
①盐酸的合适浓度为______________。
②盐酸起始浓度为2 mol·L﹣1时,铁的浸出率很低,原因是______________。
(2)已知:25℃时,Al(OH)3(s)![]() AlO2-+ H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为______________(设调节pH过程中溶液体积不变)。
AlO2-+ H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为______________(设调节pH过程中溶液体积不变)。
(3)Fe@Fe2O3纳米线为壳层结构(核是Fe、壳是Fe2O3),壳是由中心铁核在合成过程中被氧化而形成。
①“合成”时滴加NaBH4溶液过程中伴有气泡产生,滤液Ⅱ中含B(OH)3,合成铁核的离子方程式为____________________________。
②“合成”后,经过滤、______________、______________获得Fe@Fe2O3纳米线。
(4)Fe@Fe2O3纳米线去除水体中Cr2O72-的机理是,纳米线将Cr2O72-吸附在表面并还原。在“无氧”和“有氧”条件下将纳米线分别置于两份相同的水体中,80 min后回收该纳米线,测得其表面元素的原子个数比如下表:

①在水体中Fe@Fe2O3纳米线形成的分散系是____________________________。
②样本2的实验条件是______________(填“有氧”或“无氧”)。
③已知水体中检测不到Cr(Ⅲ),样本1中Fe@Fe2O3纳米线的表面Cr(Ⅵ)的去除率为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.6 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.15mol·L-1·s-1
③2s时物质A的转化率为30%
④2s时物质B的浓度为0.3 mol·L-1
其中正确的是
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是

A. 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象
B. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
C. 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率
D. 试管b中Na2CO3的作用是除去随乙酸乙酯蒸出的少量乙酸和乙醇,降低乙酸乙酯在溶液中溶解度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com