
【题目】不用任何试剂,只用试管和胶头滴管就可以鉴别开来的一组是:(1)![]() 溶液和
溶液和![]() 溶液(2)NaOH溶液和
溶液(2)NaOH溶液和![]() 溶液(3)HCl溶液和
溶液(3)HCl溶液和![]() 溶液(4)
溶液(4)![]() 溶液和氨水溶液
溶液和氨水溶液
A.(1)(2)(3)B.(2)(3)(4)C.(1)(2)D.(2)(3)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】S2O82-具有强氧化性,其还原产物为SO42-,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。请写出此反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下HClO的Ka=4.7×10-8,在c(H2SO3)+c(HSO![]() )+c(SO
)+c(SO![]() )=0.1mol·L-1的H2SO3和NaOH混合溶液中含硫微粒的物质的量分数ɑ随pH的变化曲线如图所示。下列叙述正确的是( )
)=0.1mol·L-1的H2SO3和NaOH混合溶液中含硫微粒的物质的量分数ɑ随pH的变化曲线如图所示。下列叙述正确的是( )
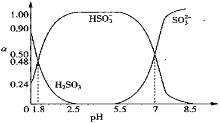
A.pH=7.2时,混合溶液中由水电离的c(H+)=10-7.2
B.等浓度的Na2SO3溶液pH比NaClO溶液的大
C.将等浓度、等体积的NaClO和Na2SO3溶液混合,混合液接近中性
D.Na2SO3溶液中:c(Na+)=2c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)
)+c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
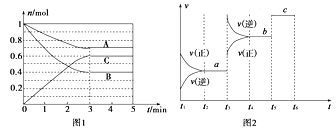
(1)该反应的化学方程式为____________________________。
(2)该反应的反应速率v随时间t的关系如上图2所示:
①根据上图判断,在t3时刻改变的外界条件是______________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的大小关系为________(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) ![]() 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
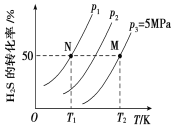
(1)△H_________ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为________________。
(3)图中M点的平衡常数Kp =_______MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向25ml氢氧化钠标准溶液中逐滴加入0.2mol·L1的一元酸HA溶液,PH变化曲线如下图所示:
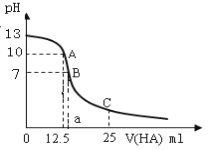
(1)该氢氧化钠溶液的物质的量浓度为__________mol·L1。
(2)A点对应酸的体积为12.5ml,则所得混合溶液中由水电离出的c(OH)= _______mol·L1。
(3)HA是____酸(选填“强”、“弱”)。
(4) 在B点所得混合溶液中,c(Na+)、c(A)、c(H+)、c(OH) 的大小的顺序是_____________。
(5)在C点所得混合溶液中,下列说正确的是________。
A.HA的电离程度小于NaA的水解程度
B.离子浓度由大到小的顺序是c(Na+)>c(A)>c(H+)>c(OH)
C.c(Na+) + c(H+) = c(A-) + c(OH)
D.c(HA) + c(A) = 0.2mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的实线表示元素周期表的边界。①~⑧分别表示元素周期表中对应位置的元素。
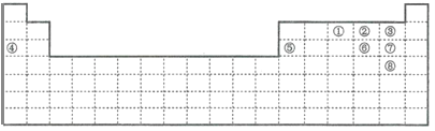
(1)元素周期表体现了元素周期律。元素周期律的本质是________。在元素周期表中,元素的位置与结构的关系是______。
(2)在上表中画出金属区和非金属区的分界线_______
(3)上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对应水化物酸性最强的是________(填分子式)。
(4)④与⑥形成的化合物溶于水后,溶液的pH________7。原因________________(用离子方程式表示),若使其熔化,需破坏的作用力有________________。
(5)元素①的氢化物电子式为________________,该分子属于________晶体。
(6)⑥⑦两元素非金属性较强的是(写元素符号)________。写出能证明这一结论的一个实验事实____。
(7)⑤、⑦各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为____。
(8)⑦的氢化物的还原性比元素⑥的氢化物的还原性________(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知煤的近代结构模型如图所示。
回答下列问题:
(1)从煤的结构模型来看,煤是工业上获得____________的重要来源。
(2)我国大约70%的煤是直接用于燃烧的。从煤的结构模型来看,在提供热量的同时产生大量的____________、____________等气体物质,造成严重的大气污染。
(3)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物苯并[α]芘的排放量也减少,同时节煤20%~30%。“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐。某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其固硫过程________________、________________。
(4)为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有____________、____________、____________等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。
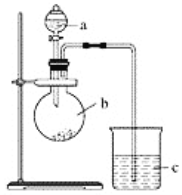
(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com