
分析 根据热化学方程式的书写方法可知,物质的物质的量与反应放出的热量成正比,并注意标明各物质的聚集状态来解答;写出热化学方程式,根据盖斯定律来分析.
解答 解:0.5mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出1082.5 kJ热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2×1082.5 kJ=2165KJ的热量,反应的热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165 kJ•mol-1;
由于①B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol,
②H2O(l)→H2O(g);△H=+44kJ/moL,
由盖斯定律可知①+②×3得:B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ/mol,
11.2L(标准状况)即0.5mol乙硼烷完全燃烧生成气态水时放出的热量是2033kJ×0.5=1016.5kJ,
故答案为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol;1016.5.
点评 本题考查了热化学方程式的书写方法和盖斯定律的计算应用以及热量的计算,需要注意的有:反应热的数值与化学方程式前面的系数成正比.题目难度中等.


科目:高中化学 来源: 题型:选择题
 的元素在周期表中的位置是( )
的元素在周期表中的位置是( )| A. | 第2周期第IIA族 | B. | 第3周期第IIIA族 | C. | 第2周期第IIIA族 | D. | 第3周期第IIA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
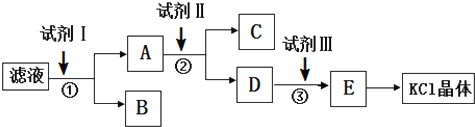
| A. | 起始滤液的pH=7 | |
| B. | 步骤②中加入试剂 II的目的是除去CO32- | |
| C. | 试剂 I为Ba(NO3)2溶液 | |
| D. | 试剂Ⅲ为稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| B. | 氢氧化钠溶液与稀盐酸反应:OH-+H+═H2O | |
| C. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ⑤⑥ | C. | ③⑥ | D. | ①⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素从上到下,其氢化物的稳定性逐渐增强 | |
| B. | 同周期元素(0族除外) 从左到右,原子半径逐渐减小 | |
| C. | 将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀 | |
| D. | Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L Na2CO3溶液:c(OH-)+c(H+)═c(HCO3-)+2c(H2CO3) | |
| B. | 0.1mol/L NH4Cl溶液:c(NH4+)+c(Cl-)═0.2mol/L | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到的pH=4的混合溶液:c(Na+)═c(NO3-) | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的水与重水含有的电子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 同温、同压、同体积的CO和NO含有的原子数 | |
| D. | 常温下等物质的量的铝分别与足量氯气、浓硝酸反应时转移的电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com