
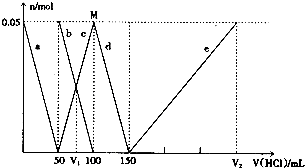
| A. | V1:V2=l:5 | |
| B. | M点时生成的CO2为0.05mol | |
| C. | 原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 | |
| D. | a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)3↓ |
分析 Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸:
首先,发生反应AlO2-+H++H2O═Al(OH)3↓,a线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知n(AlO2-)=n(H+)=0.05L×1mol/L=0.05mol;
第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,b线表示CO32-,c线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知n(CO32-)=n(H+)=0.05L×1mol/L=0.05mol;
第三阶段,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,d线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+);
第四阶段,发生反应Al(OH)3+3H+═Al3++3H2O,e线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体积为$\frac{0.15mol}{1mol/L}$=0.15L=150mL,据此结合选项解答.
解答 解:Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸:
首先发生反应AlO2-+H++H2O═Al(OH)3↓,a线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知n(AlO2-)=n(H+)=0.05L×1mol/L=0.05mol,
第二阶段,AlO2-反应完毕,开始发生反应:CO32-+H+═HCO3-,则b线表示CO32-、c线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知n(CO32-)=n(H+)=0.05L×1mol/L=0.05mol;
第三阶段,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,d线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+);
第四阶段,发生反应Al(OH)3+3H+═Al3++3H2O,e线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体积为:$\frac{0.15mol}{1mol/L}$=0.15L=150mL,
A.由上述分析可知,原混合溶液中的CO32-与AlO-2的物质的量之比为0.05mol:0.05mol=1:1,故A错误;
B.由上述分析可知M点时溶液中CO32-完全转化为HCO3-,没有CO2生成,故B错误;
C.原溶液中n(CO32-)=0.05mol,V1时溶液中碳酸氢根离子等于碳酸根离子为0.025ml,由反应CO32-+H+═HCO3-可知,需要盐酸为0.025mol,盐酸的体积为$\frac{0.025mol}{1mol/L}$=0.025L=25mL,故V1=50mL+25mL=75mL,由上述分析可知,V2=150mL+150mL=300mL,故V1:V2=75mL:300mL=l:4,故C错误;
D.由上述分析可知,a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓,故D正确;
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确图象中各曲线变化对应反应原理为解答关键,试题培养了学生的分析、理解能力及化学计算能力.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:实验题
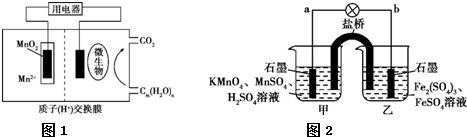
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C | B. | CO | C. | CH4 | D. | CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| C. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 | |
| D. | 常温下,Z单质与W的常见单质直接生成ZW2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物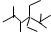 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 可用热的饱和Na2CO3溶液除去金属表面的机油、润滑油 | |
| C. | C4H10的一氯取代物有4种 | |
| D. | 用酸性KMnO4溶液可鉴别2-丁烯和正丁醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变,若起始时加入1molx和2molY,则平衡时Z的物质的量仍为0.5mol | |
| B. | 其他条件不变,再向容器中加入2 mol X和1 mol Y,平衡正向移动,平衡时X、Y的转化率增大 | |
| C. | 其他条件不变,升高一定温度后,该反应平衡常数K=2.0,则△H>0 | |
| D. | 以x浓度变化表示的反应速率为0.01 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,实验式是CH2.
,实验式是CH2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 实验 | 现象 |
| A | 检验CO2气体中混有SO2 | 将气体通入盛有足量的澄清石灰水中的洗气瓶中 | 石灰水变浑浊 |
| B | 检验黑色固体Fe3O4中含有+3价铁元素 | 将少量黑色固体加入盛有KSCN溶液的烧杯中 | 固体溶解,溶液呈血红色 |
| C | 实验室制取并收集少量NH3 | 加热NH4Cl固体,并用向上排空气法收集,将湿润的红色石蕊试纸放在瓶口 | NH4Cl固体逐渐变少,湿润的红色石蕊试纸变蓝色 |
| D | 验证氧化性:Fe3+>Cu2+ | 将一定量铜粉加到盛有一定体积的1.0mol•L-1Fe2(SO4)3溶液的试管中 | 铜粉溶解,溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com