
| A. | 2 mol•L-1 | B. | 1.6 mol•L-1 | C. | 0.8 mol•L-1 | D. | 0.4 mol•L-1 |
分析 一份用足量的氢气还原,反应后固体质量为Cu的质量,另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,根据Cu元素守恒可知:n[Cu(NO3)2]=n(Cu),根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2],再根据c=$\frac{n}{V}$计算硝酸的浓度.
解答 解:一份用足量的氢气还原,反应后固体质量为Cu的质量,故n(Cu)=$\frac{25.6g}{64g/mol}$=0.4mol,
另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,根据Cu元素守恒可知:n[Cu(NO3)2]=n(Cu)=0.4mol,根据氮元素守恒可知:n(HNO3)=n(NO)+2n[Cu(NO3)2]=$\frac{4.48L}{22.4L/mol}$+2×0.4mol=1mol,
所以该稀硝酸的浓度为:c(HNO3)=$\frac{1mol}{0.5L}$=2mol/L,
故选A.
点评 本题考查混合物反应的计算,题目难度中等,明确反应过程是解题的关键,注意利用守恒法进行解答,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制各铝的工艺流程:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制各铝的工艺流程:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
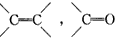 的不饱和度均为1,现有结构简式为
的不饱和度均为1,现有结构简式为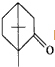 的物质,通过碳、氢原子和不饱和度的计算,确定下列物质中不是上述物质的同分异构体的是( )
的物质,通过碳、氢原子和不饱和度的计算,确定下列物质中不是上述物质的同分异构体的是( )| A. | 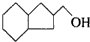 | B. |  | C. | 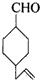 | D. | 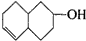 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤操作时,为了过滤效果好,要用玻璃棒搅拌 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,为了防止局部过热,要用玻璃棒搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
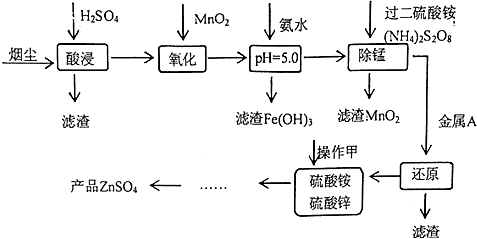
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.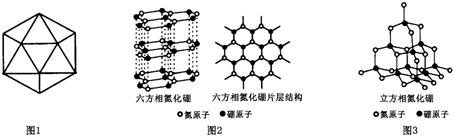
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com