
【题目】某研究小组为探究铁发生电化学腐蚀的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图甲)从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化结果如图,下列叙述错误的是( )
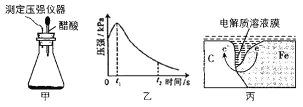
A.图丙中,发生腐蚀时电子转移方向如箭头所示
B.图乙中,t2时容器中压强明显小于起始压强是因为铁粉发生了吸氧腐蚀
C.碳粉表面的电极反应式只有:O2+4e-+2H2O=4OH-
D.若将丙图中的C 换成Zn,铁的腐蚀速率会大大降低,这是是利用了牺牲阳极的阴极保护法
【答案】C
【解析】
混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞,从胶头滴管中滴入几滴醋酸溶液,根据图乙的压强变化可知,开始时锥形瓶中压强增大,说明铁粉发生了析氢腐蚀,后随着醋酸的消耗,溶液酸性减弱,发生了吸氧腐蚀,则锥形瓶中压强减小,据此分析。
A.在形成的原电池中,铁粉作负极失去电子,碳粉作正极,氢离子或氧气在正极得电子,故电子的转移方向是由负极移向正极,A正确;
B.从胶头滴管中滴入几滴醋酸溶液,开始时锥形瓶中压强增大,说明铁粉发生了析氢腐蚀,后随着醋酸的消耗,溶液酸性减弱,说明后来发生了吸氧腐蚀,使锥形瓶中压强减小,B正确;
C.铁粉和碳粉形成原电池,碳粉作正极,开始时发生析氢腐蚀,正极反应为2H++2e-=H2↑,后来发生吸氧腐蚀,正极反应为:2H2O+O2+4e-=4OH-,C错误;
D.若将丙图中的C 换成Zn,根据金属活动性Zn>Fe,Zn作原电池的负极,失去电子,Fe作原电池的正极,因此使铁的腐蚀速率会大大降低,这是是利用了牺牲阳极的阴极保护法,D正确;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】某同学对Cl2与KI溶液的反应进行了实验探究。反应装置如下:

通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。继续通入氯气,最后溶液变为浅黄绿色。
(1)Cl2与NaOH溶液反应的化学方程式是___。
(2)KI溶液变为黄色说明氯气具有的___性,该反应的离子方程式是___。
(3)已知I2+I-![]() I3-,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
I3-,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
①实验b的目的是___。
②根据实验a中,水层中含有的粒子有___。
操作 | 实验现象 | |
a | 取2~3mL黄色溶液,加入足量CCl4,振荡静置 | CCl4层呈紫红色,水层显浅黄色 |
b | 取2~3mL饱和碘水,加入足量CCl4,振荡静置 | CCl4层呈紫红色,水层几近无色 |
③实验a中水溶液颜色变浅的原因是___。
④为保证实验的严谨性,在实验a、b的基础上,需补充一个实验,该实验为___。
(4)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化,已知1molCl2可氧化0.2molI2,该反应的化学方程式是___。
(5)根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为___。
(6)溶液最终变为浅绿色的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列说法正确的是( )
A.硫氢化钾溶液里存在水解平衡 HS-+H2O![]() H3O++S2-
H3O++S2-
B.钢铁发生电化学腐蚀的负极反应式为:Fe-3e-=Fe3+
C.已知甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧热的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
D.由0.1 mol·L-1HA溶液的pH=3,可推知NaA溶液存在A-+H2O![]() HA+OH-
HA+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线:
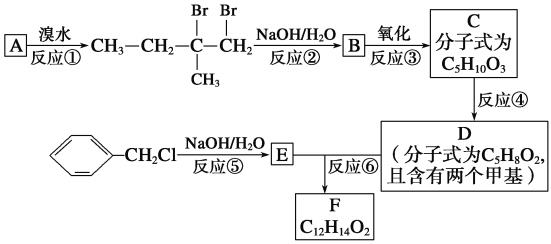
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现________种峰;峰面积比为__________。
(2)上述合成路线中属于取代反应的是__________(填编号)。
(3)写出反应⑤、⑥的化学方程式:
⑤____________________________________________________________________;
⑥____________________________________________________________________。
(4)F有多种同分异构体,请写出符合下列条件的所有物质结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为—CH2COOCH3:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数NA的叙述中不正确的是( )
A.1mol NaHSO4固体所含的阳离子数目为NA
B.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
C.标准状况下,22.4L HF含有电子数为8NA
D.60g石英晶体中含有的Si-O键数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mo1)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
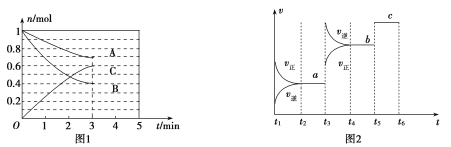
(1)该反应的化学方程式为_____________,此反应平衡常数的表达式为![]() ________。
________。
(2)从开始到平衡C的平均反应速率v(C)=________________。该反应的![]() ________0。(填“
________0。(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)
”)
(3)该反应的反应速率v随时间t的关系如图2所示:
①根据图2判断,在![]() 时刻改变的外界条件是________。
时刻改变的外界条件是________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
|
|
|
|
|
|
![]() 、
、![]() 、
、![]() 之间的关系为_______(用“
之间的关系为_______(用“![]() ”、“
”、“![]() ”或“
”或“![]() ”连接)。
”连接)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对X+Y![]() 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
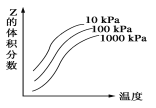
A.上述可逆反应的正反应为放热反应
B.X和Y中只有一种为气态,Z为气态
C.X、Y、Z均为气体
D.上述反应的逆反应ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有a~g7种短周期元素,它们在元素周期表中的相对位置如表所示,请回答下列问题:
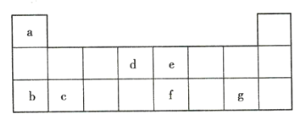
(1)下列选项中,元素的原子间最容易形成离子键的是___(填序号,下同),元素的原子间最容易形成共价键的是___。
A.c和f B.b和g C.d和g D.c和e
(2)下列由a~g7种元素原子形成的各种分子中,所有原子最外层都满足8电子稳定结构的是___(填序号)。
A.ea3 B.ag C.fg3 D.dg4
(3)由题述元素中的3种非金属元素形成的AB型离子化合物的电子式为___。
(4)c与e可形成一种化合物,试写出该化合物的化学式:___,其含有的化学键类型为___,其与过量稀盐酸反应的化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com