
| 物质的量浓度 | N2 | H2 | NH3 |
| 起始/mol•L-1 | a | 6 | 0 |
| 转化/mol•L-1 | b | c | d |
| 平衡/mol•L-1 | 1 | e | 3 |
分析 利用三段式列式计算,
N2 +3H2 ?2NH3
起始(mol/L) 2.5 6 0
转化(mol/L) 1.5 4.5 3
平衡(mol/L) 1 1.5 3
(1)所以对比表中的相关数据可知a=2.5,e=1.5;
(2)根据v=$\frac{△c}{△t}$计算反应速率;
(3)压强之比等于物质的量之比,在体积相等的条件下也等于浓度之比,据此答题;
(4)影响反应速率的因素分析,降低温度反应速率减小;
(5)反应是气体体积减小的放热反应,当达到平衡时,正逆反应速率相同,各组分含量保持不变,及其衍生的定量关系.
解答 解:利用三段式列式计算,
N2 +3H2 ?2NH3
起始(mol/L) 2.5 6 0
转化(mol/L) 1.5 4.5 3
平衡(mol/L) 1 1.5 3
(1)所以对比表中的相关数据可知a=2.5,e=1.5,故答案为:2.5;1.5;
(2)根据v=$\frac{△c}{△t}$可计算出v(N2)=$\frac{1.5mol/L}{3min}$=0.5mol/(L.min),故答案为:0.5mol/(L.min);
(3)该体系在起始时总浓度为2.5mol/L+6mol/L=8.5mol/L,平衡后的总浓度为1mol/L+1.5mol/L+3mol/L=5.5mol/L,根据压强之比等于物质的量之比,在体积相等的条件下也等于浓度之比,可知起始状态和平衡状态的压强比为8.5:5.5=17:11,故答案为:17:11;
(4)影响反应速率的因素分析,降低温度反应速率减小,故答案为:减小;
(5)A.气体质量和体积不变,无论该反应是否达到平衡状态,容器内密度始终不变,所以混合气体的密度不再变化不能判断平衡状态,故A错误;
B.该反应是一个反应前后气体体积减小的可逆反应,当容器内压强保持不变时,正逆反应速率相等,反应达到平衡状态,混合气体的压强不再变化说明反应达到平衡状态,故B正确;
C.N2的正反应速率等于逆反应速率,反 应达到平衡状态,故C正确;
D.N2的浓度保持恒定不变是反应达到平衡的标志,故D正确;
故答案为:BCD.
点评 本题主要考查了平衡状态的判断、反应速率的计算、气体压强之比等于物质的量之比等知识点,中等难度,掌握基础是关键.


科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | 物质A的转化率增大了 | ||
| C. | 物质A的质量分数减小了 | D. | 平衡向逆反应方向移动了 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0 的溶液中:Mg2+、Fe3+、NO3-、SO42- | |
| B. | 能和Ca2+生成沉淀的溶液中:Ba2+、K+、CH3COO-、Cl- | |
| C. | 能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、SO32- | |
| D. | 由水电离出的c(OH-)=1×10-13mol/L的溶液中:NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol C2H6含有6nA个共价键 | |
| B. | 标准状况下,22.4L氯水含有nA个Cl2分子 | |
| C. | 17gNH3含有10nA个质子 | |
| D. | 1molK被完全氧化生成KO2,失去2nA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlO2-、SO42-、Cl-、K+ | B. | Al3+、Ca2+、HCO3-、Na+ | ||
| C. | Fe3+、NH4+、SO42-、SCN- | D. | H+、Cl-、Na+、HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH |  | 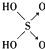 | 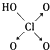 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
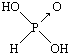 和
和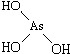 ,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性
,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷的分子式是C3H6 | |
| B. | 丙烷分子中的碳原子在一条直线上 | |
| C. | 丙烷在光照条件下能够发生取代反应 | |
| D. | 丙烷的熔点比乙烷低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
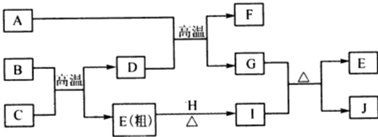
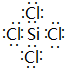 .
. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com