
| A. | 原子序数:X<Y<Z<W | B. | 单质的熔点:W>Z | ||
| C. | 热稳定性:H2Y>HX | D. | 碱性:W(OH)2>ZOH |
分析 短周期元素的X-、Y2-、Z+、W2+四种离子具有相同的电子层结构,则X、Y处于同一周期,Z、W处于同一周期,且处于X、Y所在周期上一周期,故Z、W处于第三周期,结合离子所得电荷可知,X为F、Y为O、Z为Na,W为Mg,再根据元素周期律递变规律判断.
解答 解:短周期元素的X-、Y2-、Z+、W2+四种离子具有相同的电子层结构,则X、Y处于同一周期,Z、W处于同一周期,且处于X、Y所在周期上一周期,故Z、W处于第三周期,结合离子所得电荷可知,X为F、Y为O、Z为Na,W为Mg,
A.四种离子原子序数大小顺序是Y<X<Z<W,故A错误;
B.金属晶体的原子半径越小,金属阳离子的电荷越多,金属键越强,单质的熔点越高,所以熔点:Mg>Na,故B错误;
C.元素的非金属性越强,氢化物越稳定,非金属性:F>O,则热稳定性:H2O<HF,故C错误;
D.元素的金属性越强,其最高价氧化物的水化物的碱性越强,金属性:Na>Mg,碱性:Mg(OH)2<NaOH,故D错误;
故选B.
点评 本题考查原子结构和元素周期律关系,侧重考查分析、推断、运用能力,涉及非金属性和金属性强弱判断、熔点比较等知识点,熟练掌握元素周期律知识并灵活运用,题目难度中等.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题
 H2PO4-+H+.
H2PO4-+H+.
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +(8-$\frac{2}{3}$m) | B. | +(8-2m) | C. | +(8-$\frac{3}{2}$m) | D. | +(8-3m) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肉桂酸(C6H5CH=CHCOOH)是一种常用的香料,可从桂皮中提取,还可用甲苯、氯气等为原料按如下路线合成:
肉桂酸(C6H5CH=CHCOOH)是一种常用的香料,可从桂皮中提取,还可用甲苯、氯气等为原料按如下路线合成: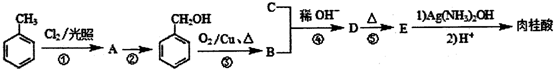
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2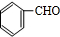 +2H2O.
+2H2O.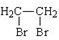
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶液中加入足量的NaOH浓溶液:NH4++OH-═NH3↑+H2O | |
| B. | 向FeBr2溶液中滴加少量氯水:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 用电子式表示HCl的形成过程: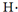 + +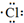 → →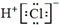 | |
| D. | 硫磺在空气中燃烧:2S+3O2$\frac{\underline{\;点燃\;}}{\;}$ 2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
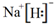 ,推测这种化合物具有较强的还原性.(填“氧化性”或“还原性”)
,推测这种化合物具有较强的还原性.(填“氧化性”或“还原性”)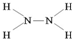 .W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质,该反应的化学方程式为4Cu(OH)2+N2H4=2Cu2O+N2↑+6H2O.
.W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质,该反应的化学方程式为4Cu(OH)2+N2H4=2Cu2O+N2↑+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正戊烷与2,2-二甲基丙烷互为同分异构体 | |
| B. | 乙醇和二甲醚互为同分异构体 | |
| C. | 乙醇、乙二醇、丙三醇互为同系物 | |
| D. | 可用溴水来区分乙醇和苯酚 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com