
【题目】利用活性铁可以很好地消除酸性水体中![]() 造成的污染,除去原理如图所示。下列说法中正确的是
造成的污染,除去原理如图所示。下列说法中正确的是

A.铁电极的电极反应式:![]()
B.![]() 在负极上发生还原反应
在负极上发生还原反应
C.除![]() 的过程中水体
的过程中水体![]() 减小
减小
D.当电路中有![]() 电子转移时,溶液中会有
电子转移时,溶液中会有![]() 生成
生成
【答案】A
【解析】
由图可知Fe还原水体中![]() ,则Fe作还原剂,失去电子发生氧化反应生成Fe3O4,Fe3O4固体疏松能导电,与电解质溶液、零价铁构成原电池,铁作负极,Fe3O4作正极,负极反应为:
,则Fe作还原剂,失去电子发生氧化反应生成Fe3O4,Fe3O4固体疏松能导电,与电解质溶液、零价铁构成原电池,铁作负极,Fe3O4作正极,负极反应为:![]() ,正极反应为:
,正极反应为:![]() +8e+10H+=
+8e+10H+=![]() +3H2O,总反应为:3Fe+
+3H2O,总反应为:3Fe+![]() +2H++H2O=Fe3O4+
+2H++H2O=Fe3O4+![]() ,据此分析解答。
,据此分析解答。
A.根据以上分析,铁做负极,失电子产生Fe3O4,电极反应式为:![]() ,故A正确;
,故A正确;
B.硝酸根离子得电子转变成铵根离子,在正极发生反应,故B错误;
C.该装置中的总反应为:3Fe+![]() +2H++H2O=Fe3O4+
+2H++H2O=Fe3O4+![]() ,消耗氢离子,使氢离子浓度减小,pH增大,故C错误;
,消耗氢离子,使氢离子浓度减小,pH增大,故C错误;
D. 正极反应为:![]() +8e+10H+=
+8e+10H+=![]() +3H2O,由反应可知每产生1mol
+3H2O,由反应可知每产生1mol![]() 转移8mol电子,当电路中有
转移8mol电子,当电路中有![]() 电子转移时,溶液中会有
电子转移时,溶液中会有![]() 生成,故D错误;
生成,故D错误;
故选:A。


科目:高中化学 来源: 题型:
【题目】1,3—环己二酮(![]() )常用作医药中间体,用于有机合成。1,3—环己二酮的一种合成路线如图所示。
)常用作医药中间体,用于有机合成。1,3—环己二酮的一种合成路线如图所示。
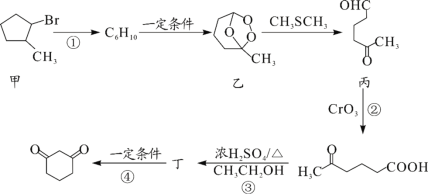
回答下列问题:
(1)甲的分子式为___。
(2)丙中含有官能团的名称是___。
(3)反应①所需的试剂和条件是___;②的反应类型是___。
(4)丁的结构简式为___。
(5)写出丙与新制氢氧化铜悬浊液反应的化学方程式___。
(6)符合下列条件的乙的同分异构体共有___种。
①能发生银镜反应
②能与NaHCO3溶液反应
其中核磁共振氢谱峰面积之比为1∶1∶2∶6的一种同分异构体的结构简式为___(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A的产量能衡量一个国家石油化工发展水平,F的碳原子数为D的两倍,以A为原料合成F,其合成路线如图所示:

(1)写出决定B、D性质的重要原子团的名称:
B________、D________。
(2)A的结构式为____________。
(3)写出下列反应的化学方程式并注明反应类型:
①______________________________________________,反应类型:__________;
②______________________________________________,反应类型:__________。
(4)实验室怎样区分B和D?_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)是第VA族元素,其单质主要用于制造合金、半导体。三氧化二锑俗称锑白,是白色粉末,不溶于水,是一种两性氧化物,主要用于白色颜料、油漆和塑料、石油化工等。某工厂用羽毛矿(主要成分为Pb4FeSb6S14)制取锑白的工艺流程如图所示:

(1)Pb4FeSb6S14中的锑元素只显一种化合价,则其化合价是______。X是一种固体单质,其成分是___(填化学式)。
(2)氯化浸出中,除铅与X外,被氧化的元素反应后均显高价,写出相应的化学方程式:______________。操作1为加水稀释,写出生成SbOCl的离子方程式:___________。
(3)试剂1通常选用氨水而不是NaOH溶液,最可能的原因是_______。操作2的内容是_________、干燥。
(4)在强碱性条件下电解Na3SbS3溶液(原理如图)可得到单质锑。
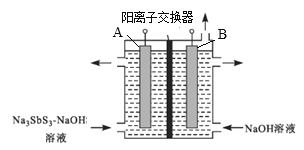
写出阴极的电极反应式:_______,B电极应接电源的______极,当有2 mol Sb生成时,通过阳离子交换膜的离子数为_________(设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】李兰娟院士团队在救治感染新型冠状病毒患者过程中,发现达芦那韦对新冠病毒有一定的抑制作用。下列有关该物质的说法正确的是

A.含有苯环,属于芳香烃
B.苯环上的一溴代物代物有5种同分异构体
C.1 mol该物质最多能与7 mol H2发生加成反应
D.不能溶于水、酸溶液、碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以北京大学马丁教授为代表的多个团队,研发出了高效的铁基(如![]() 、
、![]() 、
、![]() 、
、![]() )费托合成催化剂,以
)费托合成催化剂,以![]() 和
和![]() 为原料可高产率合成烯烃、烷烃,如
为原料可高产率合成烯烃、烷烃,如![]() 、
、![]() ,为煤的气化、液化使用开拓了新途径。
,为煤的气化、液化使用开拓了新途径。
⑴![]() 中能量最高的能级上的电子云有__________种伸展方向,位于不同方向中运动的电子的能量大小关系是_______________。当
中能量最高的能级上的电子云有__________种伸展方向,位于不同方向中运动的电子的能量大小关系是_______________。当![]() 原子电子排布由
原子电子排布由![]() 时,体系的能量_________(填“增大”或“减小”)。
时,体系的能量_________(填“增大”或“减小”)。
⑵![]() 、C、O三种元素的第一电离能由大到小的顺序为___________;
、C、O三种元素的第一电离能由大到小的顺序为___________;![]() 分子中碳原子的杂化轨道类型为________________;题干所述反应中
分子中碳原子的杂化轨道类型为________________;题干所述反应中![]() 分子中断裂的化学键类型为__________(填字母)。
分子中断裂的化学键类型为__________(填字母)。
A.2个σ键、1个![]() 键B.1个σ键、2个
键B.1个σ键、2个![]() 键C.非极性键
键C.非极性键
⑶新戊烷![]() 分子中5个碳原子形成的空间构型是_______________,该分子是________(填“极性”或“非极性”)分子。随着烃分子中碳原子数目的增加,同系物的沸点升高,其原因是_________。
分子中5个碳原子形成的空间构型是_______________,该分子是________(填“极性”或“非极性”)分子。随着烃分子中碳原子数目的增加,同系物的沸点升高,其原因是_________。
⑷碳、铁之间可形成多种化合物,其中一种化合物的晶体结构(面心立方结构)如图所示:
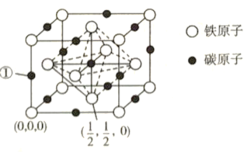
则编号为①的原子的坐标为_____________;该化合物的化学式为_____________;设该晶体的晶胞参数为![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则该晶体的密度为____________________
,则该晶体的密度为____________________![]() (列出计算式即可)。
(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积不变的密闭容器中发生反应N2(g)+3H2(g)![]() 2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
A.N2、H2、NH3的浓度之比为1∶3∶2
B.混合气体的密度不随时间变化
C.当有1molN≡N键断裂时,有6molN—H键断裂
D.单位时间内生成2amolNH3,同时消耗amolN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由水煤气合成甲醇。
(1)还可以通过下列反应制备甲醇:CO(g)+2H2(g)![]() CH3OH(g),下图是反应时CO(g)和CH3OH(g)的浓度随时间t的变化情况,从反应开始到平衡,用CO表示平均反应速率v(CO)=__________,该反应的平衡常数表达式为__。
CH3OH(g),下图是反应时CO(g)和CH3OH(g)的浓度随时间t的变化情况,从反应开始到平衡,用CO表示平均反应速率v(CO)=__________,该反应的平衡常数表达式为__。
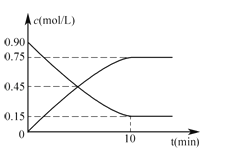
(2)在一容积可变的密闭容器中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
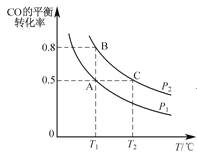
①下列说法不能判断该反应达到化学平衡状态的是_________。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA_PB(填“>、<、=”).
③若达到化学平衡状态A时,容器的体积为20 L,如果反应开始时仍充入10 mol CO和20 mol H2,则在平衡状态B时容器的体积V(B)=__L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com