
�����и�˵���У���ȷ���ǣ� ��
A������2SO2(g)+O2(g)  2SO3(g) ��H=��QkJ��mol-1��(Q��0)������Ӧ�г���1molSO2��������������Ӧʱ���ų�������һ����Q/2 kJ 2SO3(g) ��H=��QkJ��mol-1��(Q��0)������Ӧ�г���1molSO2��������������Ӧʱ���ų�������һ����Q/2 kJ |
| B���Ȼ�ѧ����ʽ�еĻ�ѧ�����������÷�����ʾ |
| C��Zn(s)+H2SO4(aq) =ZnSO4(aq)+H2(g) ��H��0���÷�Ӧ�Ļ�ѧ�ܿ���ת��Ϊ���� |
| D����H�Ĵ�С���Ȼ�ѧ����ʽ�Ļ�ѧ�������� |
 �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����Ȼ�ѧ����ʽ��д��ȷ���ǣ���H�ľ���ֵ��Ϊ��ȷֵ��
| A��2NO2��O2��2NO��H����116.2 kJ/mol����Ӧ�ȣ� |
| B��S(s)��O2(g)��SO2(g)��H����296.8 kJ/mol����Ӧ�ȣ� |
| C��NaOH(aq)��HCl(aq)��NaCl(aq)��H2O(l)��H����57.3 kJ/mol���к��ȣ� |
| D��C2H5OH(l)��2O2(g)��2CO (g)��3H2O(g)��H����801 kJ/mol��ȼ���ȣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�������������Ȼ�ѧ����ʽ��
��1��2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ��H= -Q1kJ��mol-1
��2��2H2S(g)+O2(g)=2S(g)+2H2O(g) ��H= -Q2kJ��mol-1
��3��2H2S(g)+O2(g)=2S(g)+2H2O(l) ��H= -Q3kJ��mol-1
�ж�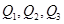 ���߹�ϵ��ȷ����
���߹�ϵ��ȷ����
| A��Q1��Q2��Q3 | B��Q1��Q3��Q2 | C��Q3��Q2��Q1 | D��Q2��Q1��Q3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���з�Ӧ������������ԭ��Ӧ���������ȷ�Ӧ����
| A����Ƭ��ϡ����ķ�Ӧ | B��Ba(OH)2?8H2O��NH4Cl�ķ�Ӧ |
| C�����ȵ�̿��CO2�ķ�Ӧ | D�������������е�ȼ�շ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵�����ʾ������ȷ����
| A�������ʵ�����������������ֱ���ȫȼ�գ����߷ų������� |
| B����C��ʯī���� C�����ʯ�� ��H����1.90 kJ/mol��֪�����ʯ��ʯī�ȶ� |
| C����101kPaʱ��2g������ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ�� 2H2(g)+O2(g)��2H2O(l) ��H����285.8kJ/mol |
| D����ϡ��Һ�У�H+(aq)+ OH-(aq)��H2O(l) ��H����57.3kJ/mol��������0.5molH2SO4��Ũ�����뺬1molNaOH����Һ��ϣ��ų����ȴ���57.3kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ͺ�����������Ӧ�����������ı仯��ϵ��ͼ��E��ʾ������������˵����ȷ����( )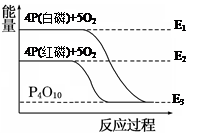
| A�����ױȺ����ȶ� |
| B������ȼ�������ȷ�Ӧ |
| C������ת��Ϊ���������ȷ�Ӧ |
| D������ȼ�յ��Ȼ�ѧ����ʽ��4P(s) + 5O2(g)=P4O10(s) ��H=(E2��E3)kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪�����ĸ��Ȼ�ѧ����ʽ:
2H2S(g)+3O2(g)��2SO2(g)+2H2O(g) ��H1�� 2H2S(g)+3O2(g)��2SO2(g)+2H2O(l) ��H2��
2H2S(g)+O2(g)��2S(s)+2H2O(g) ��H3�� 2H2S(g)+O2(g)��2S(s)+2H2O(l) ��H4��
���H���ߵĹ�ϵ����ȷ����
| A����H1����H2����H3����H4 | B����H4����H2����H3����H1 |
| C����H3����H4����H1����H2 | D����H4����H3����H2����H1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���л�ѧ�仯�У���Ӧ�����������������������������ǣ� ��
A��2H2 +O2 2H2O 2H2O | B��CaO + H2O= Ca��OH��2 |
C��CaCO3 CaO + CO2�� CaO + CO2�� | D��CH3CH2OH���ƾ���+ 3O2 2CO2 + 3 H2O 2CO2 + 3 H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪Zn(s)+ H2SO4(aq)= ZnSO4(aq)+ H2(g) ��H<0����������������ȷ����
| A���÷�Ӧ�Ħ�Hֵ�뷴Ӧ�������� |
| B���÷�Ӧ�Ļ�ѧ�ܿ���ת��Ϊ���� |
| C����Ӧ�������������������������� |
| D���÷�Ӧ�з�Ӧ��Ļ�ѧ�����ѷų������������ﻯѧ���γ��������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com