
”¾ĢāÄæ”æŹµŃéŹŅÓŠŅ»Ī“ÖŖÅØ¶ČµÄŃĪĖį£¬Ä³Ķ¬Ń§ŌŚŹµŃéŹŅÖŠ½ųŠŠŹµŃé²ā¶ØŃĪĖįµÄÅØ¶Č”£ĒėĶź³ÉĻĀĮŠĢīæÕ£ŗ
ÅäÖĘ100mL0.10molL-1NaOH±ź×¼ČÜŅŗ”£Č”20.00mL“ż²āŃĪĖį·ÅČė׶ŠĪĘæÖŠ£¬µĪ¼Ó 2~3µĪ·ÓĢŖ×÷ÖøŹ¾¼Į£¬ÓĆÅäÖʵıź×¼ NaOHČÜŅŗ½ųŠŠµĪ¶Ø”£ÖŲø“ÉĻŹöµĪ¶Ø²Ł×÷ 2~3“Ī£¬¼ĒĀ¼Źż¾ŻČēĻĀ£ŗ
µĪ¶Ø“ĪŹż | “ż²āŃĪĖįµÄĢå»ż/mL | 0.10 mol/L NaOH ČÜŅŗµÄĢå»ż/mL | |
µĪ¶ØĒ°æĢ¶Č | µĪ¶ØŗóæĢ¶Č | ||
µŚŅ»“Ī | 20.00 | 2.00 | 28.15 |
µŚ¶ž“Ī | 20.00 | 1.50 | 29.50 |
µŚČż“Ī | 20.00 | 0.20 | 26.55 |
¢ŁøĆŹµŃéµĪ¶Ø“ļµ½ÖÕµćµÄ±źÖ¾ŹĒ____
¢Śøł¾ŻÉĻŹöŹż¾Ż£¬æɼĘĖć³öøĆŃĪĖįµÄÅضČŌ¼ĪŖ___”££Ø±£ĮōĮ½Ī»ÓŠŠ§Źż×Ö£©
¢ŪŌŚÉĻŹöŹµŃéÖŠ£¬ĻĀĮŠ²Ł×÷£ØĘäĖū²Ł×÷ÕżČ·£©»įŌģ³É²ā¶Ø½į¹ūĘ«øßµÄÓŠ____”££ØĖ«Ń”£©
A.µĪ¶ØÖÕµć¶ĮŹżŹ±ø©ŹÓ¶ĮŹż
B.ĖįŹ½µĪ¶Ø¹ÜŹ¹ÓĆĒ°£¬Ė®Ļ“ŗóĪ“ÓĆ“ż²āŃĪĖįČóĻ“
C.׶ŠĪĘæĖ®Ļ“ŗóĪ“øÉŌļ
D.¼īŹ½µĪ¶Ø¹Ü¼ā×ģ²æ·ÖÓŠĘųÅŻ£¬µĪ¶ØŗóĻūŹ§
E.³ĘĮæNaOH ¹ĢĢåŹ±£¬»ģČėÉŁĮæKOHŌÓÖŹ
¢ÜĻÖÓĆŅŌÉĻŹµŃéÅäÖʵÄ0.10molL£1NaOHČÜŅŗµĪ¶ØĪ“ÖŖÅØ¶ČµÄCHCOOHČÜŅŗ£¬·“Ó¦Ē”ŗĆĶźČ«Ź±£¬ĻĀĮŠŠšŹöÖŠÕżČ·µÄŹĒ___
A.ČÜŅŗ³ŹÖŠŠŌ£¬æÉŃ”ÓĆ¼×»ł³Č»ņ·ÓĢŖ×÷ÖøŹ¾¼Į
B.ČÜŅŗ³ŹÖŠŠŌ£¬Ö»ÄÜŃ”ÓĆŹÆČļ×÷ÖøŹ¾¼Į
C.ČÜŅŗ³Ź¼īŠŌ£¬æÉŃ”ÓĆ¼×»ł³Č»ņ·ÓĢŖ×÷ÖøŹ¾¼Į
D.ČÜŅŗ³Ź¼īŠŌ£¬Ö»ÄÜŃ”ÓĆ·ÓĢŖ×÷ÖøŹ¾¼Į
”¾“š°ø”æµ±µĪČė×īŗóŅ»µĪNaOHČÜŅŗŹ±£¬ČÜŅŗÓÉĪŽÉ«Ē”ŗƱä³ÉĒ³ŗģÉ«£¬²¢ĒŅŌŚ°ė·ÖÖÓÄŚ²»ĶŹÉ« 0.13molL-1 DE D
”¾½āĪö”æ
¢ŁČēČÜŅŗŃÕÉ«±ä»ÆĒŅ°ė·ÖÖÓÄŚ²»±äÉ«£¬æÉĖµĆ÷“ļµ½µĪ¶ØÖÕµć£»
¢Śøł¾ŻµĪ¶ØĻūŗĵıź×¼ŅŗµÄĢå»żÅŠ¶ĻŹż¾ŻµÄÓŠŠ§ŠŌ£¬Č»ŗó¼ĘĖć³ö±ź×¼ŅŗµÄĘ½¾łĢå»ż£¬×īŗóøł¾Ż±źc(“ż²ā)=![]() ¼ĘĖć³öøĆŃĪĖįµÄÅØ¶Č£»
¼ĘĖć³öøĆŃĪĖįµÄÅØ¶Č£»
¢Ūøł¾Żc(“ż²ā)=![]() ·ÖĪö²»µ±²Ł×÷¶ŌV£Ø±ź×¼£©µÄÓ°Ļģ£¬ŅŌ“ĖÅŠ¶ĻÅØ¶ČµÄĪó²ī£»
·ÖĪö²»µ±²Ł×÷¶ŌV£Ø±ź×¼£©µÄÓ°Ļģ£¬ŅŌ“ĖÅŠ¶ĻÅØ¶ČµÄĪó²ī£»
¢Üøł¾ŻŃĪĄąµÄĖ®½āæ¼ĀĒČÜŅŗµÄĖį¼īŠŌ£¬Č»ŗóøł¾ŻÖøŹ¾¼ĮµÄ±äÉ«·¶Ī§ÓėĖį¼īÖŠŗĶŗóµÄŌ½½Ó½üŌ½ŗĆ£¬ĒŅ±äÉ«Ć÷ĻŌ”£
¢ŁµĪ¶Ø½įŹųĒ°ŃĪĖįÖŠµĪČė·ÓĢŖ£¬ČÜŅŗĪŖĪŽÉ«£¬µĪ¶Ø½įŹųŹ±ĒāŃõ»ÆÄĘ¹żĮ棬ČÜŅŗ±ä³ÉĒ³ŗģÉ«£¬ĖłŅŌµĪ¶ØÖÕµćĻÖĻóĪŖ£ŗ×īŗóŅ»µĪĒāŃõ»ÆÄĘČÜŅŗ¼ÓČė£¬ČÜŅŗÓÉĪŽÉ«Ē”ŗƱä³ÉĒ³ŗģÉ«£¬ĒŅ°ė·ÖÖÓÄŚĒ³ŗģÉ«²»ĶŹČ„£»
¹Ź“š°øĪŖ£ŗµ±µĪČė×īŗóŅ»µĪNaOHČÜŅŗŹ±£¬ČÜŅŗÓÉĪŽÉ«Ē”ŗƱä³ÉĒ³ŗģÉ«£¬²¢ĒŅŌŚ°ė·ÖÖÓÄŚ²»ĶŹÉ«£»
¢ŚµŚ¶ž“ĪŹż¾ŻĪó²ī½Ļ“󣬊čÉįČ„£¬Ļūŗıź×¼ŅŗµÄĘ½¾łĢå»żĪŖ£ŗ![]() mL =26.25 mL£¬
mL =26.25 mL£¬
øĆŃĪĖįµÄÅضČĪŖ£ŗc£ØHCl£©=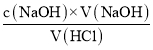 ØT
ØT![]() ”Ö0.13molL-1£»
”Ö0.13molL-1£»
¹Ź“š°øĪŖ£ŗ0.13molL-1£»
¢ŪA£®µĪ¶ØÖÕµć¶ĮŹżŹ±ø©ŹÓ¶ĮŹż£¬Ōģ³ÉV£Ø±ź×¼£©Ę«Š”£¬øł¾Żc(“ż²ā)=![]() ·ÖĪö£¬æÉÖŖc(“ż²ā)Ę«Š”£»
·ÖĪö£¬æÉÖŖc(“ż²ā)Ę«Š”£»
B£®ĖįŹ½µĪ¶Ø¹ÜŹ¹ÓĆĒ°£¬Ė®Ļ“ŗóĪ“ÓĆ“ż²āŃĪĖįČóĻ“£¬“ż²āŅŗ±»Ļ”ŹĶ£¬ĘäĪļÖŹµÄĮæĘ«Š”£¬Ōģ³ÉV£Ø±ź×¼£©Ę«Š”£¬øł¾Żc(“ż²ā)=![]() ·ÖĪö£¬æÉÖŖc(“ż²ā)Ę«Š”£»
·ÖĪö£¬æÉÖŖc(“ż²ā)Ę«Š”£»
C£®×¶ŠĪĘæĖ®Ļ“ŗóĪ“øÉŌļ£¬“ż²āŅŗµÄĪļÖŹµÄĮæ²»±ä£¬¶ŌV£Ø±ź×¼£©ĪŽÓ°Ļģ£¬øł¾Żc(“ż²ā)=![]() ·ÖĪö£¬æÉÖŖc(“ż²ā)²»±ä£»
·ÖĪö£¬æÉÖŖc(“ż²ā)²»±ä£»
D£®µĪ¶ØĒ°µĪ¶Ø¹Ü¼ā×ģ“¦ÓŠĘųÅŻ£¬µĪ¶ØŗóĘųÅŻĻūŹ§£¬Ōģ³ÉV£Ø±ź×¼£©Ę«“ó£¬øł¾Żc(“ż²ā)=![]() ·ÖĪö£¬æÉÖŖc(“ż²ā)Ę«“ó£»
·ÖĪö£¬æÉÖŖc(“ż²ā)Ę«“ó£»
E. ³ĘĮæNaOH ¹ĢĢåŹ±£¬»ģČėÉŁĮæKOHŌÓÖŹ£¬Ōņ±ź×¼ŅŗµÄÅØ¶Č»įĘ«Š”£¬Ōģ³ÉV£Ø±ź×¼£©Ę«“ó£¬øł¾Żc(“ż²ā)=![]() ·ÖĪö£¬æÉÖŖc(“ż²ā)Ę«“ó£»
·ÖĪö£¬æÉÖŖc(“ż²ā)Ę«“ó£»
¹Ź“š°øĪŖ£ŗDE£»
¢ÜŹµŃéŹŅ³£ÓĆ3ÖÖÖøŹ¾¼ĮµÄpH±äÉ«·¶Ī§ČēĻĀ£ŗ¼×»ł³Č£ŗ3.1”«4.4£» ŹÆČļ£ŗ5.0”«8.0£» ·ÓĢŖ£ŗ8.2”«10.0£¬ŹÆČļ±äÉ«²»Ć÷ĻŌ£¬NaOHČÜŅŗµĪŗĶCH3COOHČÜŅŗ·“Ó¦Ē”ŗĆĶźČ«Ź±£¬Éś³ÉĮĖCH3COONa£¬CH3COONaĖ®½āČÜŅŗ³Ź¼īŠŌ£¬Ó¦Ń”Ōń¼īŠŌ·¶Ī§ÄŚ±äÉ«µÄÖøŹ¾¼Į£¬¼“·ÓĢŖ£¬DĻīÕżČ·£¬¹Ź“š°øĪŖ£ŗD”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ [ŹµŃé»Æѧ]
3£¬4ŃĒ¼×¶žŃõ»ł±½¼×ĖįŹĒŅ»ÖÖÓĆĶ¾¹ć·ŗµÄÓŠ»śŗĻ³ÉÖŠ¼äĢ壬Ī¢ČÜÓŚĖ®£¬ŹµŃéŹŅæÉÓĆKMnO4Ńõ»Æ3£¬4ŃĒ¼×¶žŃõ»ł±½¼×Č©Öʱø£¬Ęä·“Ó¦·½³ĢŹ½ĪŖ

ŹµŃé²½ÖčČēĻĀ£ŗ
²½Öč1£ŗĻņ·“Ó¦ĘæÖŠ¼ÓČė3£¬4ŃĒ¼×¶žŃõ»ł±½¼×Č©ŗĶĖ®£¬æģĖŁ½Į°č£¬ÓŚ70”«80 ”ęµĪ¼ÓKMnO4ČÜŅŗ”£·“Ó¦½įŹųŗ󣬼ÓČėKOHČÜŅŗÖĮ¼īŠŌ”£
²½Öč2£ŗ³ĆČČ¹żĀĖ£¬Ļ“µÓĀĖ±ż£¬ŗĻ²¢ĀĖŅŗŗĶĻ“µÓŅŗ”£
²½Öč3£ŗ¶ŌŗĻ²¢ŗóµÄČÜŅŗ½ųŠŠ“¦Ąķ”£
²½Öč4£ŗ³éĀĖ£¬Ļ“µÓ£¬øÉŌļ£¬µĆ3£¬4ŃĒ¼×¶žŃõ»ł±½¼×Ėį¹ĢĢ唣
£Ø1£©²½Öč1ÖŠ£¬·“Ó¦½įŹųŗó£¬Čō¹Ū²ģµ½·“Ó¦Ņŗ³Ź×ĻŗģÉ«£¬ŠčĻņČÜŅŗÖŠµĪ¼ÓNaHSO3ČÜŅŗ£¬![]() ×Ŗ»ÆĪŖ_____________£ØĢī»ÆѧŹ½£©£»¼ÓČėKOHČÜŅŗÖĮ¼īŠŌµÄÄæµÄŹĒ____________________________”£
×Ŗ»ÆĪŖ_____________£ØĢī»ÆѧŹ½£©£»¼ÓČėKOHČÜŅŗÖĮ¼īŠŌµÄÄæµÄŹĒ____________________________”£
£Ø2£©²½Öč2ÖŠ£¬³ĆČČ¹żĀĖ³żČ„µÄĪļÖŹŹĒ__________________£ØĢī»ÆѧŹ½£©”£
£Ø3£©²½Öč3ÖŠ£¬“¦ĄķŗĻ²¢ŗóČÜŅŗµÄŹµŃé²Ł×÷ĪŖ__________________”£
£Ø4£©²½Öč4ÖŠ£¬³éĀĖĖłÓƵÄ×°ÖĆ°üĄØ_______________”¢ĪüĀĖĘ攢°²Č«ĘæŗĶ³éĘų±Ć”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ĢÖÜĘŚÖ÷×åŌŖĖŲX”¢Y”¢Z”¢WµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó”£ZŌ×Ó2p¹ģµĄÉĻÓŠ3øöĪ“³É¶Ōµē×Ó”£¼×”¢ŅŅ”¢±ū”¢¶””¢ĪģŹĒÕāĖÄÖÖŌŖĖŲÖ®¼äŠĪ³ÉµÄ»ÆŗĻĪļ£¬75%µÄ¼×ČÜŅŗ³£ÓĆÓŚĻū¶¾£¬ĪģŹĒZŗĶX×é³ÉµÄ10µē×Ó·Ö×Ó£¬³£ĪĀĻĀŅŃČÜŅŗĻŌÖŠŠŌ£¬ĖüĆĒ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£¬ŌņĻĀĮŠĖµ·ØÖŠ“ķĪóµÄŹĒ
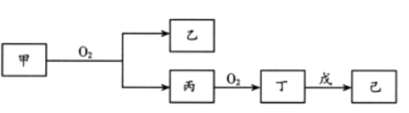
A.ĖÄÖÖŌŖĖŲŌ×Ó°ė¾¶Óɓ󵽊”µÄĖ³ŠņĪŖ£ŗY£¾Z£¾W£¾X
B.WµÄĒā»ÆĪļÖŠµÄijŅ»ÖÖ¾ßÓŠĘư׊Ō
C.±ūµÄµē×ÓŹ½ĪŖ![]()
D.WµÄĒā»ÆĪļ·ŠµćŅ»¶Ø±ČYµÄĒā»ÆĪļ·Šµćøß
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗ2Fe2++Cl2===2Cl©+2Fe3+£¬2Br©+Cl2===Br2+2Cl©£¬2Fe2++Br2===2Br©+2Fe3+”£ŗ¬ÓŠamol FeBr2µÄČÜŅŗÖŠ£¬ĶØČėxmol Cl2£¬ĻĀĮŠø÷ĻīĪŖĶØCl2¹ż³ĢÖŠ£¬ČÜŅŗÄŚ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½£¬ĘäÖŠ²»ÕżČ·µÄŹĒ£Ø””””£©
A. x=0.4a£¬2Fe2++Cl2===2Fe3++2Cl©
B. x=0.6a£¬2Br©+Cl2===Br2+2Cl©
C. x=a£¬2Fe2++2Br©+2Cl2===Br2+2Fe3++4Cl©
D. x=1.5a£¬2Fe2++4Br©+3Cl2===2Br2+2Fe3++6Cl©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ1£¬3£¶”¶žĻ©ŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬¹¤ŅµÉĻ³£ÓĆ1-¶”Ļ©“ß»ÆĶŃĒāµÄ·½·ØÖʱø”£½«0.lmol1£¶”Ļ©ŗĶ0.675molĖ®ÕōĘų×é³ÉµÄ»ģŗĻĘų£¬ŌŚ80kPaŗćŃ¹ĻĀ½ųŠŠ·“Ó¦£ŗCH3CH2CH=CH2(g)![]() CH2=CHCH=CH2(g)+H2(g)”÷H”£
CH2=CHCH=CH2(g)+H2(g)”÷H”£
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ŅŃÖŖ»Æѧ¼ü¼üÄÜŹż¾ŻČēĻĀ£¬ÓÉ“Ė¼ĘĖć”÷H=____________kJmo1-1”£
»Æѧ¼ü | C£C | C=C | C£H | H£H |
¼üÄÜ/kJmol-1 | 348 | 612 | 412 | 436 |
(2)ČēĶ¼±ķŹ¾ĶŃĒā·“Ó¦ÖŠĪĀ¶Č¶Ō1£¶”Ļ©µÄĘ½ŗā×Ŗ»ÆĀŹµÄÓ°Ļģ£¬¹¤ŅµÉś²śĶس£æŲÖĘ·“Ó¦ĪĀ¶Č600”ę”£
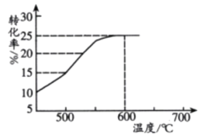
¢ŁĒė½āŹĶ¹¤ŅµÉś²śæŲÖĘĪĀ¶ČŌŚ600”ęµÄŌŅņ___________”£
¢Ś“ĖĪĀ¶ČĻĀ·“Ó¦½ųŠŠ2.5hŗó“ļµ½Ę½ŗā£¬“ÓæŖŹ¼·“Ó¦µ½½ØĮ¢Ę½ŗā£¬ŅŌH2±ķŹ¾µÄ·“Ó¦ĖŁĀŹĪŖv(H2)=_________kPah-1£»ĶŃĒā·“Ó¦µÄĘ½ŗā³£ŹżKp=_________kPa(KpĪŖŅŌ·ÖŃ¹±ķŹ¾µÄĘ½ŗā³£Źż£¬p·Ö=p×Ü”ĮĪļÖŹµÄĮæ·ÖŹż)”£
(3)ŌŚĆܱÕČŻĘ÷ÖŠ·“Ó¦“ļµ½Ę½ŗāŗó£¬ŌŁ³äČė1.575mol1£¶”Ļ©ŗĶ1.625mol1£¬3£¶”¶žĻ©£¬»Æѧ·“Ó¦Ļņ_________(Ģī”°Õż·“Ó¦”±”¢”°Äę·“Ó¦»ņ”°²»ŅĘ¶Æ”±)·½Ļņ½ųŠŠ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖĶłĢå»ż¹Ģ¶ØµÄĆܱÕČŻĘ÷ÖŠĶØČėµČĪļÖŹµÄĮæµÄNO2ŗĶCO£¬·“Ó¦ÖŠµÄCOŗĶNOµÄÅضČĖꏱ¼ä±ä»ÆµÄŹ¾ŅāĶ¼ČēĶ¼”£øł¾ŻĶ¼Ņā»Ų“šĻĀĮŠĪŹĢā£ŗ
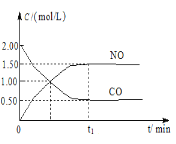
£Ø1£©“Ó·“Ó¦æŖŹ¼µ½Ę½ŗā£¬ÓĆNO2ÅØ¶Č±ä»Æ±ķŹ¾Ę½¾ł·“Ó¦ĖŁĀŹ¦Ō(NO2)£½___”£
£Ø2£©830KŹ±£¬ŌŚĆܱÕČŻĘ÷ÖŠ·¢ÉśĻĀĮŠæÉÄę·“Ó¦£ŗCO£Øg£©+H2O£Øg£©![]() CO2£Øg£©+H2£Øg£©”÷H£¼0”£ŹŌ»Ų“š£ŗ
CO2£Øg£©+H2£Øg£©”÷H£¼0”£ŹŌ»Ų“š£ŗ
¢ŁČōĘšŹ¼Ź±c£ØCO£©=2mol”¤L-1£¬c£ØH2O£©=3mol”¤L-1£¬“ļµ½Ę½ŗāŹ±COµÄ×Ŗ»ÆĀŹĪŖ60%£¬ŌņŌŚøĆĪĀ¶ČĻĀ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżK=____”£
¢ŚŌŚĻąĶ¬ĪĀ¶ČĻĀ£¬ČōĘšŹ¼Ź±c£ØCO£©=1mol”¤L-1£¬c£ØH2O£©=2mol”¤L-1£¬·“Ó¦½ųŠŠŅ»¶ĪŹ±¼äŗ󣬲āµĆH2µÄÅضČĪŖ0.5mol”¤L-1£¬Ōņ“ĖŹ±øĆ·“Ó¦ŹĒ·ń“ļµ½Ę½ŗāדĢ¬___£ØĢī”°ŹĒ”±Óė”°·ń”±£©£¬“ĖŹ±¦Ō£ØÕż£©__¦Ō£ØÄę£©£ØĢī”°“óÓŚ”±”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ĢÖÜĘŚÖ÷×åŌŖĖŲX”¢Y”¢Z”¢WµÄŌ×ÓŠņŹżŅĄ“ĪµŻŌö£¬XŹĒÖÜĘŚ±ķÖŠ·Ē½šŹō×īĒæµÄŌŖĖŲ£¬WÓėXĶ¬Ö÷×壬Y”¢ZŹĒĶ¬ÖÜĘŚĻąĮŚµÄĮ½ÖÖŌŖĖŲ£¬ZŌŖĖŲŌ×Ó×īĶā²ćµē×ÓŹżµČÓŚÖÜĘŚŠņŹż”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A.Ō×Ó°ė¾¶µÄ“óŠ”Ė³Šņ£»![]()
B.¼ņµ„Ēā»ÆĪļµÄČČĪČ¶ØŠŌ£ŗ![]()
C.×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄ¼īŠŌ£ŗ![]()
D.¹¤ŅµÉĻ£¬³£ÓƵē½āŗ¬Y»ņZ¼ņµ„Ąė×ÓČÜŅŗµÄ·½·ØŅ±Į¶µ„ÖŹY»ņZ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ·“Ó¦ŹōÓŚĶ¬ÖÖĪļÖŹÖŠĶ¬Ņ»¼ŪĢ¬µÄĶ¬Ņ»ŌŖĖŲ²æ·Ö±»Ńõ»Æ£¬²æ·Ö±»»¹ŌµÄŃõ»Æ»¹Ō·“Ó¦µÄŹĒ(””””)
A.3Br2+6KOH![]() 5KBr+KBrO3+3H2O
5KBr+KBrO3+3H2O
B.MnO2+4HCl(ÅØ)![]() MnCl2+Cl2”ü+2H2O
MnCl2+Cl2ӟ+2H2O
C.2KNO3![]() 2KNO2+O2ӟ
2KNO2+O2ӟ
D.NH4NO3![]() N2Oӟ+2H2O
N2Oӟ+2H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¹żŃõ»ÆÄĘ³£×÷ĘÆ°×¼Į”¢É±¾ś¼Į”¢Ļū¶¾¼Į”£¹żŃõ»ÆÄʱ£“ę²»µ±ČŻŅ×ĪüŹÕæÕĘųÖŠCO£²¶ų±äÖŹ”£
£Ø1£©Ä³æĪĶā»ī¶ÆŠ”×éÓūĢ½¾æij¹żŃõ»ÆÄĘѳʷŹĒ·ńŅŃ¾±äÖŹ£¬Č”ÉŁĮæѳʷ£¬Čܽā£¬¼ÓČė__________ČÜŅŗ£¬³ä·ÖÕńµ“ŗóÓŠ°×É«³Įµķ£¬Ö¤Ć÷Na2O2ŅŃ¾±äÖŹ”£
£Ø2£©øĆæĪĶā»ī¶ÆŠ”×éĪŖĮĖ“ÖĀŌ²ā¶Ø¹żŃõ»ÆÄʵēæ¶Č£¬ĖūĆĒ³ĘČ”a gѳʷ£¬²¢Éč¼ĘÓĆĻĀĶ¼×°ÖĆĄ“²ā¶Ø¹żŃõ»ÆÄʵÄÖŹĮæ·ÖŹż”£

¢ŁAÖŠ·¢Éś·“Ó¦Ąė×Ó·½³ĢŹ½ĪŖ_____________________”£
¢Ś½«ŅĒĘ÷Į¬½ÓŗĆŅŌŗ󣬱ŲŠė½ųŠŠµÄµŚŅ»²½²Ł×÷ŹĒ_____________________”£
¢ŪB×°ÖĆ³öĄ“µÄĘųĢåŹĒ·ńŠčŅŖøÉŌļ_________________”££ØĢī”°ŹĒ”±»ņ”°·ń”±£©
¢ÜŠ“³ö×°ÖĆCÖŠ·¢ÉśµÄĖłÓŠ·“Ó¦µÄ»Æѧ·½³ĢŹ½_____________£¬______________”£
¢ŻDÖŠNaOHČÜŅŗµÄ×÷ÓĆ_______________________”£
¢ŽŹµŃé½įŹųŹ±£¬¶ĮČ”ŹµŃéÖŠÉś³ÉĘųĢåµÄĢå»żŹ±£¬²»ŗĻĄķµÄŹĒ_______________”£
a.Ö±½Ó¶ĮČ”ĘųĢåĢå»ż£¬²»ŠčĄäČ“µ½ŹŅĪĀ
b.ÉĻĻĀŅʶÆĮæĶ²£¬Ź¹µĆE”¢FÖŠŅŗĆęø߶ČĻąĶ¬
c.ŹÓĻßÓė°¼ŅŗĆęµÄ×īµĶµćĻąĘ½¶ĮČ”ĮæĶ²ÖŠĖ®µÄĢå»ż
¢ß¶Į³öĮæĶ²ÄŚĖ®µÄĢå»żŗó£¬ÕŪĖć³É±ź×¼×“æöĻĀŃõĘųµÄĢå»żĪŖV mL£¬Ōņѳʷ֊¹żŃõ»ÆÄʵÄÖŹĮæ·ÖŹżĪŖ__________________”£
¢ąŹµŃéĶź³ÉŗóEµ½FÖ®¼äµ¼¹ÜÄŚ²ŠĮōĖ®µÄĢå»ż»įŹ¹²āĮæ½į¹ū__________”££ØĢī”°Ę«“ó”±”¢”°Ę«Š””±»ņ”°²»Ó°Ļģ”±£©
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com