
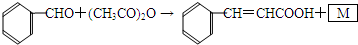

 ,
, ;取代反应;
;取代反应;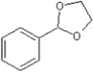 ,
, ;
;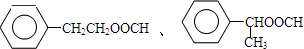 ,
,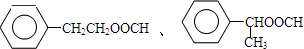 .
.


科目:高中化学 来源: 题型:
| 元素编号 元素性质 |
X | Y | Z | W | E | F | G | H |
| 原子半径 /10-10m |
0.66 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.70 | 1.43 |
| 最高或最 低化合价 |
+2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| A、元素X与H形成的化合物能与元素X与F形成的化合物反应 |
| B、元素G与W比较,非金属G比W强,所以其单质的反应活性也是G比W强 |
| C、元素G与E形成的分子GE3的空间构型呈平面三角形 |
| D、元素Z的最高价氧化物对应的水化物是易溶于水的强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 1mol?L-1的NaClO 溶液中含有ClO-的数目为NA |
| B、pH=1的醋酸溶液中,CH3COO-和OH-数目之和为0.1NA |
| C、78g苯中含有碳碳双键的数目为3NA |
| D、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、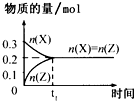 |
B、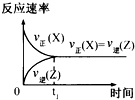 |
C、 |
D、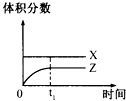 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COONH4的电离方程式为:CH3COONH4?CH3COO-+NH4+ | ||||
| B、NaHS的水解方程式为:HS-+H2O?S2-+H3O+ | ||||
| C、用过量的氨水吸收SO2的离子方程式为:2NH3?H2O+SO2═2NH4++SO32-+H2O | ||||
D、过量Fe粉与Cl2反应的化学方程式为:Fe+Cl2
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com