
����Ŀ��ijͬѧ������ʵ��װ�����ʵ���Ʊ�SO2�����������̽�����
����֪������ǿ��ΪH2SO3��H2CO3��HClO��

��1��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ_________________________________________��
��2����ͬѧ������װ����ѡ����ʵ�װ����֤��������̼�������ǿ���������õ���C��Dװ�á�
��Cװ�õ�������___________________________��
��ͨ��___________________________________________________����ʵ��������֤������������ǿ��̼�ᡣ
��3����ͬѧ��Ϊ��������װ��Ҳ����֤�������������ǿ�ڴ����ᣬ��д����ȷ��װ������˳��A��( )��( ) �� C �� F ��____________
��4����ͬѧ��A�в�����������SO2ͨ����ͼװ��G�У�G���а�ɫ�������ɡ��ó����Ļ�ѧʽΪ_________��
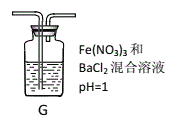
I���Ʋ����������ԭ�������(�����ǿ�����Ӱ��)
ԭ��һ��SO2�����������±�NO3��������
ԭ�����SO2��Fe3+������
ԭ������_____________________________________________��
II�������ͬѧ��Ϊ����Ϊ��ԭ����������˰�ɫ������
������д��SO2��Fe3+���������ӷ���ʽ��_________________________________
�ڼ���Fe3+ǡ����ȫ��Ӧ���������ʵ��֤���仹ԭ�������Ҫ����ʵ����̡������ۡ�
___________________________________
���𰸡� Na2SO3+H2SO4(Ũ)=Na2SO4+SO2��+H2O ����SO2�Ƿ���� C��Ʒ����Һ����ɫ��E��ʯ��ˮ����� A����B������D����C��F BaSO4 SO2��Fe3+�����������µ�NO3���������˷�Ӧ SO2 +2Fe3+ + 2H2O = SO42��+2Fe2++ 4H+ ȡ������Ӧ����ϲ���Һ���Թ��У��μӼ���K3[Fe(CN)6]��Һ������ɫ�������ɣ�˵����Ӧ����Fe2+���ɣ������KSCN�������ټ�����ˮ��Һ��Ѫ��ɫ����Fe2+����Ҳ������������֤����Ӧ����Һ����Fe2+������������
����������1��Ũ�������������Ʒ�Ӧ���������ơ�����������ˮ����ѧ����ʽΪ��Na2SO3+H2SO4(Ũ)=Na2SO4+SO2��+H2O ����ȷ���� Na2SO3+H2SO4(Ũ)=Na2SO4+SO2��+H2O��
��2���ٶ�������Ͷ�����̼���������ʯ��ˮ��Ӧ���ɰ�ɫ������Ϊ����֤����������ǿ��̼�ᣬֻ��֤���ж�����̼���ɼ��ɣ���Ҫ��ȥ��������Cװ�þ���Ϊ�˼���SO2�Ƿ��������C��Ʒ����Һ����ɫ��E��ʯ��ˮ����ǣ�˵���ж�����̼���ɣ�������������ǿ��̼���ȷ��������SO2�Ƿ���� ��
��C��Ʒ����Һ����ɫ��˵�����������Ѿ�������E��ʯ��ˮ����� ��˵���ж�����̼�����������ȷ���� C��Ʒ����Һ����ɫ��E��ʯ��ˮ�����
��3��������Aװ�ò�����������ͨ��Bװ����̼�����Ʋ���������̼������Dװ�������Ը�����س�ȥ����������Cװ�ü�����������Ƿ���������ͨ��Fװ�ã���Fװ���г��ְ�ɫ��������˵��̼������ǿ�ڴ����ᣬ��ϣ�2������֤������������ǿ�ڴ����ᣬ��װ������˳��ΪA��B��D��C��F����ȷ����A����B������D����C��F��
(4)����������л�ԭ�����������������ܹ�����������ӻ�����������Ϊ���������������������뱵���ӷ�Ӧ�������ᱵ��ɫ���������Գ���ΪBaSO4 ����ȷ����BaSO4��
I��SO2�����������±�NO3��������SO2��Fe3+�����������������£�SO2��Fe3+��NO3����������ȷ�𰸣�SO2��Fe3+�����������µ�NO3���������˷�Ӧ ��
II����SO2��Fe3+����Ϊ��������ӣ������ӱ���ԭΪ�������ӣ����ӷ���ʽ��SO2 +2Fe3+ + 2H2O = SO42��+2Fe2++ 4H+ ����ȷ����SO2 +2Fe3+ + 2H2O = SO42��+2Fe2++ 4H+ ��
�ڼ���Fe3+ǡ����ȫ��Ӧ����Һ�к����������ӣ��������ӵļ��鷽�����ȼ�KSCN�������ټ�����ˮ��Һ��Ѫ��ɫ����Fe2+����μ�K3[Fe(CN)6]��Һ������ɫ�������ɣ�˵�������������ӣ���ȷ�𰸣�ȡ������Ӧ����ϲ���Һ���Թ��У��μӼ���K3[Fe(CN)6]��Һ������ɫ�������ɣ�˵����Ӧ����Fe2+���ɣ������KSCN�������ټ�����ˮ��Һ��Ѫ��ɫ����Fe2+����Ҳ������������֤����Ӧ����Һ����Fe2+���������ɡ���


 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��ˮ�ĵ���ﵽƽ�⣺H2OH++OH����H��0������������ȷ���ǣ� ��
A.��ˮ�м��백ˮ��ƽ�������ƶ���c��OH��������
B.��ˮ�м������������������ƣ�c��H+������KW����
C.��ˮ�м�����������CH3COONa��ƽ�������ƶ���c��H+������
D.��ˮ���ȣ�KW����pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�ʵ��װ�õ������У�����ȷ���� �� ��
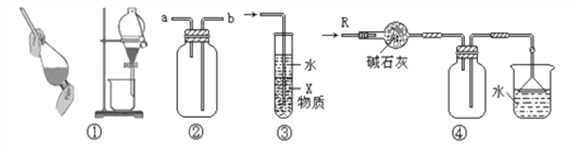
A. װ�âٿ����ڷ���ƾ���ˮ�Ļ����
B. װ�âڿ������ռ�NH3��Cl2��SO2��NO2������
C. װ�â���X��ΪCCl4������������NH3��HCl������ֹ����
D. װ�âܿ����ڸ���ռ�NH3�������ն����NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaCl��Ʒ�л���������CaCl2��NaBr�������г���������Ƶô�����NaCl��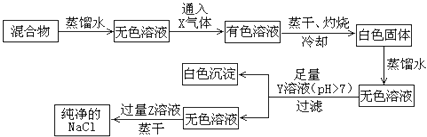
��1��X������ �� Y��Һ�� �� Z��Һ�� ��
��2������ʱ����©�����Ҫ�IJ��������� ��
��3������Y��Һ��Ŀ���������ڲ�ʹ��pH��ֽ������£�����Y��Һ�Ƿ������ķ����ǣ���Ҫ�ش�������̼����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ԣ١���Ԫ���ڱ��е�λ�ã��ش��������⣺

��1����Ԫ����Ԫ�����ڱ��е�λ��Ϊ________________________��
��2��д���ں���10�����ӵĺ��صĻ�ѧ����______________��
��3���ڢ�����������������Ԫ���У������Ӱ뾶���ɴ�С������˳��Ϊ_______________________________________________���������ӷ��űȽϴ�С��
��4������������Ԫ���������⻯����ȶ�����ǿ������˳����_______________________________________________�����û�ѧʽ�Ƚ�ǿ����
��5����д���ٵ��⻯����������Ļ�ѧ����ʽ______________________________��
��6���ɢڢܢ�����Ԫ����ɵ�һ�����ڿ����з��û���ʣ����û�ѧ����ʽ��ʾ���ʵķ�Ӧ_______________________________________________��
��7���ڢ���ߵĵ����У���ѧ���ʽϻ��õ���___________���ѧʽ����������������ʵ֤���������۵���_____________��
a��Ԫ�آ��ʵ��۵��Ԫ�آߵ��ʵ��۵��
b��Ԫ�آߵ��⻯���Ԫ�آ��⻯���ȶ�
c��Ԫ�آߵ��⻯���ˮ��Һ������ǿ��Ԫ�آ��⻯���ˮ��Һ������
d��һ�������¢͢ߵĵ��ʷֱ���Cu��Ӧʱ���߲����е�ͭԪ�ؼ�̬����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о����֣�ϸ��GFAJ-1�����û�ѧԪ���飨As)ȡ����(P)���뻯������ɡ��������������ȷ���ǣ� ��
A.��ϸ�������Ԫ���飨As)����������Ȼ�����Ҳ���
B.As�ڸ�ϸ�����ڵĺ���������Ԫ��
C.��ϸ��ͨ�����Ѳ����Ӵ�
D.��ϸ�������������һ����¶����״DNA����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������һ��Ԫ����ɣ����ܶ�Ϊ5 g��cm3����X�����о��ù���Ľ�����������ⳤΪ1��10-7cm���������к���20��ԭ�ӣ����Ԫ�ص����ԭ��������ӽ��� ��
A. 32B. 65C. 140D. 150
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ��һ���ܴ�������ģ� ��
A.����Al�ܷų�H2����Һ�У�ClO����HCO ![]() ��SO
��SO ![]() ��NH
��NH ![]()
B.pH=2����Һ�У�Fe2+��Na+��Mg2+��NO ![]()
C.��ʹKSCN��Һ������Һ�У�Na+��I����NO ![]() ��HCO
��HCO ![]()
D.��ˮ�������c��OH����=1.0��10��13mol?L��1����Һ�У�Na+��Ba2+��Cl����Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A.��������Һ�м��������ˮ��Al3++3OH���TAl��OH��3��
B.��������Һ�еμ�Ba��OH��2��Һ��Al3+�պó�����ȫ��2Al3++3SO42��+3Ba2++6OH���T3BaSO4��+2Al��OH��3��
C.NH4HCO3���ڹ�����NaOH��Һ�У�HCO ![]() +OH���TCO
+OH���TCO ![]() +H2O
+H2O
D.ϡ�����м������ۣ�2Fe+6H+�T2Fe3++3H2��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com