
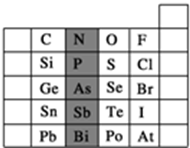
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.分析 (1)由P元素在周期表中的位置可知,处于第三横行、15列;同主族自上而下,非金属性减弱,非金属性越强,最高价含氧酸的酸性越弱;
(2)As元素的原子核内质子数为33,则Sn原子序数为33-1+18=50,阳离子核外电子数=质子数-电荷数;
(3)A.同周期自左而右原子半径减小;
B.同周期自左而右非金属性增强;
C.对于短周期元素,两种简单离子可能相差3个电子层,如H+与S2-、Cl-;
D.非金属性越强,氢化物还原性越弱;
(4)阴离子核外电子数=质子数+电荷数,质量数=质子数+中子数.
解答 解:(1)由P元素在周期表中的位置可知,处于第三横行、15列,故N元素处于第二周期ⅤA族;
同主族从上到下非金属性减弱,则最高价含氧酸的酸性越弱,则酸性H3PO4>H3AsO4,
故答案为:第三周期ⅤA族;>;
(2)As元素的原子核内质子数为33,则Sn原子序数为33-1+18=50,Sn2+的核外电子数为50-2=48,
故答案为:48;
(3)A.同周期自左而右原子半径减小,故C、N、O、F的原子半径随着原子序数的增大而减小,故A错误;
B.同周期自左而右非金属性增强,故Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强,故B正确;
C.对于短周期元素,两种简单离子可能相差3个电子层,如H+与S2-、Cl-,故C错误;
D.非金属性F>Cl>Br>I,非金属性越强,氢化物还原性越弱,HF、HCl、HBr、HI的还原性依次增强,故D错误,
故选:B;
(4)在离子RO3n-中含有x个核外电子,则RO3n-中质子数为x-n,故R的质子数为x-n-24,R原子的质量数为A,则R原子中子数是A-(x-n-24),
故答案为:A-(x-n-24).
点评 本题考查位置结构性质的关系及应用,难度不大,注意对元素周期律的理解掌握,理解掌握同主族原子序数关系.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极附近溶液的碱性减弱 | |
| B. | 放电时,电子由Zn经导线转移到K2FeO4 | |
| C. | 放电时每转移3mol电子,正极有1mol K2FeO4被还原 | |
| D. | 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉与硝酸反应失去电子数一定为0.3×6.02×1023 | |
| B. | 反应MgCl2(s)═Mg(s)+Cl2(g)的△H<0、△S>0 | |
| C. | Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 | |
| D. | 0.1 mol•L-1 Na2SO3溶液中:c(OH-)-c(H+)=2c(H2SO3)+c(HS${o}_{3}^{-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| B. | 取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 用渗析法除去淀粉中混有的NaCl | |
| D. | 已知${I}_{3}^{-}$?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L的NaHCO3溶液中:[Na+]>[HCO3-]>[OH-]>[H+] | |
| B. | 在0.1mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| C. | 向氨水中逐滴加入盐酸至溶液的pH=7,则混合液中:[NH4+]=[Cl-] | |
| D. | pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗amolD,同时生成2amolC | |
| B. | 3v(B)正=2v(C)逆 | |
| C. | 容器内的压强不再变化 | |
| D. | C(B);C(C);C(D)=3;2;1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com