
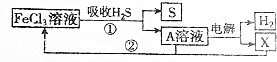
| A. | A溶液中溶质的成分为FeCl2 | B. | X为Cl2并且在阴极上生成的 | ||
| C. | 废气中的H2S最终转化为S和H2 | D. | 只有流程①为氧化还原反应 |
分析 氯化铁与硫化氢发生氧化还原反应生成盐酸、S和氯化亚铁,过滤后滤液中含HCl、FeCl2,电解时发生2HCl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑,氯气将氯化亚铁氧化为氯化铁,则氯化铁可循环利用,以此来解答.
解答 解:A、A溶液中溶质的成分为HCl、FeCl2,故A错误;
B、氯离子在阳极上放电生成氯气,故B错误;
C、废气中的H2S最终转化为S和H2,故C正确;
D、流程①为FeCl3与H2S反应生成S和Fe2+,离子反应为2Fe3++H2S═2Fe2++S↓+2H+,是氧化还原反应,而流程②为亚铁离子与氯气发生氧化还原反应,故D错误;
故选C.
点评 本题考查较综合,涉及离子反应、电极反应、H2S的化学性质等知识点,把握流程图熟练运用氧化还原反应是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
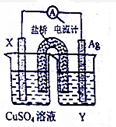 I、依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
I、依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比苯酚溶液大 | B. | 比苯酚溶液小 | ||
| C. | 与苯酚溶液相等 | D. | 无法和苯酚溶液比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极的电极反应式为2I--2e-═I2 | |
| B. | 正极的电极反应式为AsO43-+2H++2e-?AsO33-+H2O | |
| C. | 利用酸度计(ph计)测定溶液的pH,若溶液的pH不再发生变化,应达到平衡 | |
| D. | 利用该反应设计原电池,利用毫安表测定电池的电流强度,当电池达到最大时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
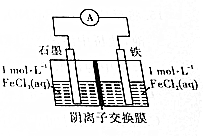
| A. | FeCl3和FeCl2可以互换位置,对反应无影响 | |
| B. | 该电池总反应为FeCl3+Fe═2FeCl2 | |
| C. | 若溶解2.8g铁,约有0.1molCl-从交换膜左向右迁移 | |
| D. | 一段时间后,阴膜左、右侧离子数变化量之比约为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C0(NH2)2 | B. | NH4NO3 | C. | NH4HCO3 | D. | (NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
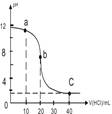
| A. | a点时,溶液呈碱性,溶液中c(B+)>c(Cl-) | |
| B. | b点时溶液的pH=7 | |
| C. | 当c(B+)=c(Cl-)时,v(HCl)<20mL | |
| D. | c点时溶液的c(H+)约为0.03mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g | B. | 13.6 g | C. | 5.8g | D. | 4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com