
科目:高中化学 来源:2017届内蒙古高三上月考二化学卷(解析版) 题型:选择题
只用一种试剂,可区别Na2SO4、AlCl3、NH4Cl、MgSO4四种溶液,这种试剂是( )
A.HCl B.BaCl2  C.AgNO3 D.NaOH
C.AgNO3 D.NaOH
查看答案和解析>>
科目:高中化学 来源:2017届江西省赣州市十四校高三上期中联考化学试卷(解析版) 题型:选择题
下列装置或操作能达到实验目的的是( )

A.用图1实验可证明非金属性Cl>C>Si
B.用图2所示装置可除去NO2中的NO
C.用图3装置制备Fe(OH)2并能较长时间观察其颜色
D.图4实验装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省六校协作体高三上学期期中化学试卷(解析版) 题型:选择题
元素X的单质及X和Y形成的化合物能按如图所示的关系发生转化(其中m≠n,且均为正整数)。下列说法正确的是
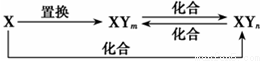
A. X为Fe,Y可为Cl、Br
B. X为Fe,Y只能为Cl
C. X一定为金属元素
D. X为Fe,Y可为Cl、Br、I
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省六校协作体高三上学期期中化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.NaAlO2溶液中通入过量CO2:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32-
B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.氧化铜溶于浓硝酸:CuO+2H+=Cu2++H2O
 D.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三10月月考化学卷(解析版) 题型:实验题
甲酸正丁酯是重要的有机原料,可通过酯化反应制得。已知A的核磁共振氢谱吸收峰的高度比为3:2:2:1,丙烯在通常条件下稳定,但遇强氧化剂时容易被氧化生成CO2。
Ⅰ.正丁醇(CH3CH2CH2CH2OH)的制备。
某研究性学习小组为合成正丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2 A(液态)
A(液态)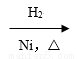 正丁醇;
正丁醇;
(1)已知反应1的原子理论利用率为100%,请写出A的结构简式 。
(2)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 (填序号,试剂可以重复使用)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液
③石灰水 ④无水CuSO4 ⑤品红溶液
Ⅱ.甲酸正丁酯的合成。
某研究性学习小组利用如图装置进一步合成甲酸正丁酯。
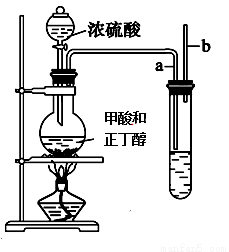
(3)大试管中溶液的作用除了溶解正丁醇外,还有 。
(4)若大试管中溶液是NaOH溶液,则收集到的产物比预期的少,其原因是 。
(5)已知反应结束后烧瓶中是甲酸、正丁醇、甲酸正丁酯和硫酸的混合物,为了回收大量未反应的甲 酸和正丁醇,该研究性小组根据相关理化性质设计以下分离操作步骤流程图。
甲酸 | 正丁醇 | 甲酸正丁酯 | |
熔点/℃ | 8.4 | -88.9 | -91 |
沸点/℃ | 100.8 | 117.7 | 107 |
溶解性 | 三者能相互溶解。 | ||
上述流程图中,操作1是 ,试剂b是 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三10月月考化学卷(解析版) 题型:选择题
化学与生活、社会发展息息相关,下列说法不正确的是( )
A.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
B.“霾尘积聚难见路 人”,雾霾所形成的气溶胶有丁达尔效应
人”,雾霾所形成的气溶胶有丁达尔效应
C.“青蒿 一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
D.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上质量调查二化学卷(解析版) 题型:选择题
下列各组离子在给定条件下不能大量共存的是( )
①在pH=1的溶液中:NH4+、K+、ClO-、Cl-
②有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I-
③有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
④在c(H+)=1.0×10-1mol-L-1的溶液中:Na+、S2-、AlO2-、SO32-
⑤含有大量Al3+的溶液:Na+、NH4+、SO42-、HCO3-
⑥含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-.
A.④ B.①②④ C.②④⑤⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2017届山西省大同市高三上学期第一次调研化学试卷(解析版) 题型:填空题
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
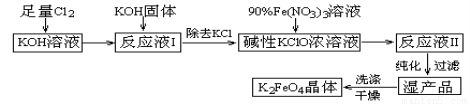
已知:
①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2 FeO4可作为新型多功能水处理剂的原因是 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为 ;
(5)在“反应液I”中加KOH固体的目的是 :
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品 (写化学式)。
(7)该工艺每得到1.98 kg K2FeO4,理论上消耗Cl2的物质的量为 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com