
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下表(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大:
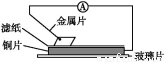
金属 | 电子流动方向 | 电压/V |
甲 | 甲→Cu | +0.78 |
乙 | Cu→乙 | -0.25 |
丙 | 丙→Cu | +1.35 |
丁 | 丁→Cu | +0.30 |
依据记录数据判断,下列结论中正确的是( )
A.将甲、乙形成的合金露置在空气中,甲先被腐蚀
B.金属乙能从硫酸铜溶液中置换出铜
C.在四种金属中丙的还原性最弱
D.甲、丁若形成原电池时,甲为正极
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考化学名师高考模拟演练练习卷(B)(解析版) 题型:选择题
下述实验能达到预期目的的是( )
编号实验内容实验目的
A将含有HCl杂质的CO2通入饱和Na2CO3溶液中除去CO2中的HCl
B将适量一定量的NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤分离出NaCl晶体
C在淀粉-KI溶液中滴加少量市售食盐配制的溶液鉴别真假碘盐
D将少量Fe(NO3)2试样加水溶解,滴加稀H2SO4酸化,再滴加KSCN溶液检验Fe(NO3)2试样是否变质
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 有机物组成练习卷(解析版) 题型:选择题
某工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等)。下列有关该物质的说法不正确的是( )
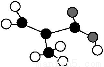
A.该物质的分子式为C4H6O2
B.该物质能发生加成反应、取代反应和氧化反应
C.该物质的最简单的同系物的结构简式为CH2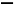 CHCOOH
CHCOOH
D.该物质是石油分馏的一种产物
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 化学反应中的能量变化练习卷(解析版) 题型:选择题
某新型碱性可充电电池,能长时间保持稳定的放电电压。该电池的总反应为3Zn+2K2FeO4+8H2O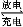 3Zn(OH)2+2Fe(OH)3+4KOH,以下说法错误的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,以下说法错误的是( )
A.电池放电是化学能转化成电能的过程
B.放电时正极反应为:Fe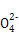 +4H2O+3e-
+4H2O+3e- Fe(OH)3+5OH-
Fe(OH)3+5OH-
C.充电时电池的负极接外电源的正极
D.充电时电解质溶液中的阴离子向阳极定向移动
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 化学反应中的能量变化练习卷(解析版) 题型:选择题
胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3 kJ的热量。下列热化学方程式书写正确的是( )
A.2H2(g)+O2(g)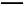 2H2O(l) ΔH=-285.8 kJ/mol
2H2O(l) ΔH=-285.8 kJ/mol
B.CH4(g)+2O2(g)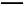 CO2(g)+2H2O(l)ΔH=-890.3 kJ/mol
CO2(g)+2H2O(l)ΔH=-890.3 kJ/mol
C.CH4(g)+2O2(g)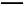 CO2(g)+2H2O(g)ΔH=-890.3 kJ/mol
CO2(g)+2H2O(g)ΔH=-890.3 kJ/mol
D.CH4(g)+2O2(g)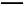 CO2(g)+2H2O(l)ΔH=+890.3 kJ/mol
CO2(g)+2H2O(l)ΔH=+890.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 化学与STSE练习卷(解析版) 题型:选择题
下列叙述不正确的是( )
A.“海沙危楼”是由于海沙带有腐蚀性,会腐蚀混凝土中的钢筋等
B.食用地沟油对人体危害极大,是因为含有黄曲霉素等有毒物质
C.开发利用太阳能、风能、生物能、海洋能等清洁能源,符合“低碳经济”
D.光化学烟雾、温室效应、硝酸型酸雨的形成都只与氮氧化物有关
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 NA的应用练习卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.0.5 mol O3与11.2 L O2所含的分子数一定相等
B.常温常压下,78 g Na2O2和Na2S的混合物中含有的阴离子数为NA
C.2SO2(g)+O2(g)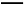 2SO3(g)和SO2(g)+
2SO3(g)和SO2(g)+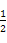 O2(g)
O2(g) SO3(g)的ΔH相等
SO3(g)的ΔH相等
D.物质的量浓度为0.25 mol/L的MgCl2溶液中,含有Cl-个数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学反应原理练习卷(解析版) 题型:填空题
Ⅰ.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解,则化学方程式为 。
其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”)。
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命。以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为 。
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,化学反应为:2Al+3Ag2O+2NaOH+3H2O 2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
,正极附近溶液的pH (填“变大”、“不变”或“变小”)。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
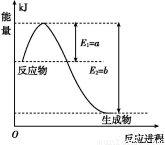
(1)如图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
A.增大压强 B.增大反应物的浓度
C.使用催化剂 D.降低温度
Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题:黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为:3FeS2+8O2 6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com