
(一)酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。某学生用0.1032 mol·L-1的氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取25.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准NaOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________。
(2)重复三次的实验数据如下表所示:
实验序号 | 消耗0.1032 mol·L-1的氢氧化钠溶液的体积/mL | 待测盐酸溶液的体积/mL |
1 | 28.84 | 25.00 |
2 | 27.83 | 25.00 |
3 | 27.85 | 25.00 |
则待测HCl的物质的量浓度是________mol·L-1。
(3)滴定至终点的现象是 。
(4)下列操作中可能使所测盐酸的浓度数值偏低的是 。
A.碱式滴定管未用标准溶液润洗就直接注入标准液
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
(5)若用同浓度的氨水与同浓度的盐酸混合至二者恰好完全中和时,该溶液中离子浓度大小关系为 。
(二)从海水中提取溴的工业流程如图:
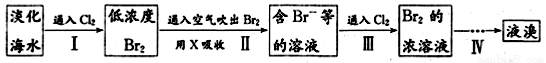
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是 。
(2)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式: 。
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源:2015-2016学年广西柳州铁路一中高一上12月月考化学卷(解析版) 题型:选择题
在下列条件下,两种气体的分子数一定相等的是 ( )
A.同密度、同压强的N2和C2H4 B.同温度、同体积的O2和N2
C.同体积、同密度的C2H4和CO D.同压强、同体积的O2和N2
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上12月月考化学试卷(解析版) 题型:选择题
在一定温度下可逆反应N2+3H2 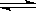 2NH3已达到平衡,下列有关说法正确的 ( )
2NH3已达到平衡,下列有关说法正确的 ( )
①1个N≡N键断裂的同时,有3个H—H键形成
②反应混合物中各组分的体积分数保持不变
③恒温恒容时,容器内的压强不再改变
④1个N≡N键断裂的同时,有3个N—H键形成
⑤NH3生成的速率与NH3分解的速率相等
⑥单位时间生成nmolN2,同时生成2nmolNH3
⑦气体的平均相对分子质量不再改变
⑧N2H2NH3的分子数一定为1∶3∶2
⑨恒温恒容时,气体的总物质的量不再改变
⑩恒温恒压时,容器内的密度不再改变
A、①②③④⑤⑥⑦⑨ B、①②③⑤⑥⑩ C、③④⑤⑥⑦ ⑧ D、①②③⑤⑥⑦⑨⑩
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期末考试化学试卷(解析版) 题型:计算题
计算题:将0.2molMg、Al的混合物用盐酸完全溶解,放出标准状况下5.6L气体,然后再滴入2mol/LNaOH溶液,请回答:
(1)求该混合物中Mg、Al的物质的量?(写计算过程)
(2)若该Mg、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V= ml。
(3)若该Mg、Al混合物溶于200ml 3mol/L盐酸后,滴入NaOH溶液,使所得沉淀中无Al(OH)3,则滴入NaOH溶液的体积最少为 ml。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一上期末考试化学试卷(解析版) 题型:选择题
镁粉加入到很稀的硝酸中发生反应:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O在该反应中被还原的硝酸和未被还原的硝酸的物质的量比为 ( )
A.4:10 B.1:9 C.1:5 D.1:7
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学试卷(解析版) 题型:选择题
海水提镁的主要流程如下:
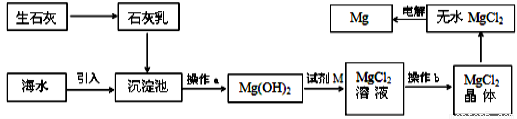
下列说法正确的是
①试剂M是盐酸
②流程中的反应全部都是非氧化还原反应
③操作b只是过滤
④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤电解熔融MgCl2比电解熔融的MgO制金属镁更节约能量
A.①②③④⑤ B.②③ C.④⑤ D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高一上期末化学卷(解析版) 题型:实验题
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。现有一红色粉末可能含有Fe2O3和Cu2O中的一种或两种,设计合理的实验探究样品中Fe2O3、Cu2O的存在。
查阅数据知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
请完成以下实验探究过程:
(一)提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是__________________;
假设3:红色粉末是___________________。
(二)设计实验方案
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是_________________________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______________。简述你的理由________________________。
(3)若固体粉末完全溶解,向所得溶液中滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是_______________。写出实验过程中发生反应的离子方程式________________、_______________、__________________。
(4)若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第四次摸底考试化学试卷(解析版) 题型:推断题
Ⅱ.选修5——有机化学基础
常用药——羟苯水杨胺,其合成路线如下。回答下列问题:
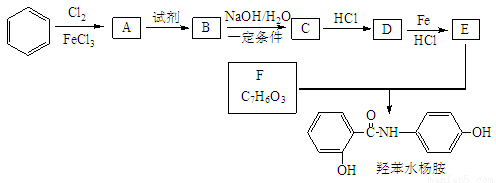
已知:

(1)羟苯水杨胺的化学式为 。对于羟苯水杨胺,下列说法正确的是______。
A.1 mol羟苯水杨胺最多可以和2 mol NaOH反应
B.不能发生硝化反应
C.可发生水解反应
D.可与溴发生取代反应
(2)D的名称为 。
(3)A→B所需试剂为 ;D→E反应的有机反应类型是 。
(4)B→C反应的化学方程式为 。
(5)F存在多种同分异构体。
①F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是 。
A.质谱仪 B.红外光谱仪 C.元素分析仪 D.核磁共振仪
②F的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应的物质共有 种;
写出其中核磁共振氢谱显示4组峰,且峰面积之比为1:2:2:1的同分异构体的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上学期12月月考化学试卷(解析版) 题型:选择题
在下列变化①工业制盐酸 ②工业制漂粉精 ③实验室制氯气中,按氯元素被氧化、被还原、既被氧化又被还原的顺序排列,正确的是
A.①②③ B.②①③ C.③①② D. ①③②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com