考点:硅和二氧化硅,海水资源及其综合利用,金属冶炼的一般原理
专题:化学应用
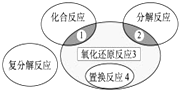
分析:A.从铝土矿中分离出氧化铝的过程:①溶于NaOH溶液中发生Al
2O
3+2NaOH═2NaAlO
2+H
2O,②偏铝酸钠溶液的酸化发生AlO
2-+H
++H
2O═Al(OH)
3↓,③灼烧氢氧化铝固体发生2Al(OH)
3Al
2O
3+3H
2O,然后根据元素化合价来解答;
B.二氧化硅为绝缘体,不导电;
C.化学变化一定有新物质生成;
D.根据电解熔氯化物来制备Na、Mg,电解熔氧化物来制备Al.
解答:
解:A.从铝土矿中分离出氧化铝的过程:①溶于NaOH溶液中发生Al
2O
3+2NaOH═2NaAlO
2+H
2O,②偏铝酸钠溶液的酸化发生AlO
2-+H
++H
2O═Al(OH)
3↓,③灼烧氢氧化铝固体发生2Al(OH)
3Al
2O
3+3H
2O,3个反应元素化合价都未发生变化,不涉及氧化还原反应,故A正确;
B.二氧化硅为绝缘体,不能用于制造电池,用于制造电池的是硅,故B错误;
C.海水中含有大量的钠元素,由钠离子变化为钠单质,有新物质生成属于化学变化,故C错误;
D.电解熔融氯化钠、氯化镁来分别制备Na、Mg,电解熔融氧化铝来制备Al,故D错误.
故选:A.
点评:本题考查了元素化合物知识,明确物质的性质是解题关键,注意二氧化硅与硅性质和用途的区别.



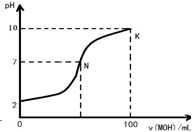 常温下,向l00mL 0.01mol?L-1 盐酸中逐滴加入0.02mol?L-1 MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中不正确的是( )
常温下,向l00mL 0.01mol?L-1 盐酸中逐滴加入0.02mol?L-1 MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中不正确的是( )