
| A. | Li的原子结构示意图为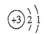 | B. | 原子半径:P>S | ||
| C. | 酸性:H3PO4<H2SO4 | D. | Li、Ge、P、S都属于短周期元素 |
分析 A、Li的质子数为3,第一层最多容纳2,余下1个电子排在第二层;
B、同周期核电荷数越多半径越小;
C、中心元素的非金属性越强,最高价氧化物对应的水化物的酸性越强;
D、Ge第四周期元素,是长周期元素.
解答 解:A、Li的质子数为3,第一层最多容纳2,余下1个电子排在第二层,所以Li的原子结构示意图为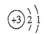 ,故A正确;
,故A正确;
B、同周期核电荷数越多半径越小,所以原子半径:P>S,故B正确;
C、中心元素的非金属性越强,最高价氧化物对应的水化物的酸性越强,所以H3PO4<H2SO4,故C正确;
D、Ge第四周期元素,是长周期元素,故D错误;
故选D.
点评 本题考查原子结构示意图、原子半径大小的比较、酸性强弱的比较和元素在周期表中的位置,综合性强,但比较容易.


科目:高中化学 来源: 题型:解答题
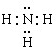 ,B的结构式为
,B的结构式为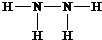 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
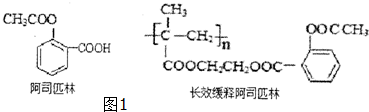
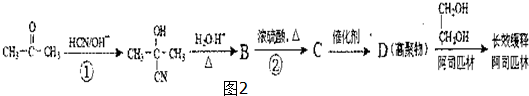
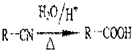 ,回答问题:
,回答问题: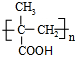 .
.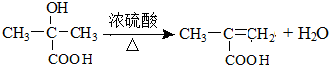 .
.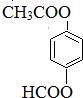 (只写一种).
(只写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
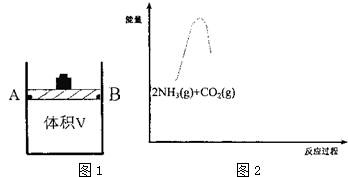
| CO2转化率 T(℃) | 10min | 20min | 30min | 40min |
| T1 | 30% | 65% | 75% | 75% |
| T | 45% | 50% | a1 | a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Z>W>Y>X | |
| B. | 气态氢化物的稳定性Z>W | |
| C. | Y的最高价氧化物对应的水化物可与其气态氢化物发生化合反应 | |
| D. | X的气态氢化物与足量W单质在光照条件下反应所得生成物均为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
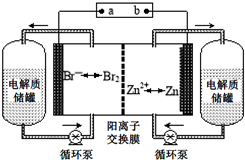 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 放电时左侧电解质储罐中的离子总浓度增大 | |
| B. | 充电时电极a连接电源的负极 | |
| C. | 放电时负极的电极反应式为Zn-2e-═Zn2+ | |
| D. | 阳离子交换膜可阻止Br2与Zn直接发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
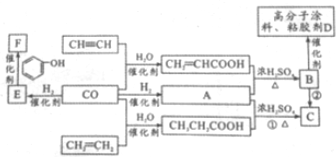
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
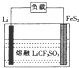 Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )| A. | Li为电池的正极 | |
| B. | 电池工作时,Li+向负极移动 | |
| C. | 正极的电极反应式为FeS2+4e-=Fe+2S2- | |
| D. | 将熔融的LiCF2SO4改为LiCl的水溶液,电池能更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
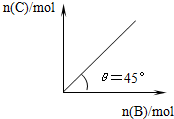 在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:| A. | 若保持压强一定,当温度升高后,则图中θ>45° | |
| B. | 若再加入B,则正、逆反应速率均逐渐增大 | |
| C. | 平衡时B的转化率为50% | |
| D. | 若保持压强一定,再加入B,则平衡后反应体系气体密度减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com