

| ||
| ||
| 5.40g |
| 108g/mol |
| 0.05mol |
| 4 |


科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素在周期表中的位置,反映了元素的原子结构和元素的性质,如图是元素周期表的一部分:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,如图是元素周期表的一部分:查看答案和解析>>
科目:高中化学 来源: 题型:
 )是一种重要的化工原料,请回答下列问题:
)是一种重要的化工原料,请回答下列问题: )的流程如下(条件略)
)的流程如下(条件略)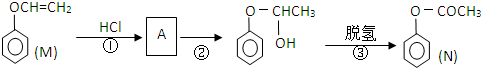
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.二甲醚是一种重要的新型清洁燃料j可替代氟利昂作制冷剂,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
I.二甲醚是一种重要的新型清洁燃料j可替代氟利昂作制冷剂,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙、丁四种物质的转化关系如图所示,其中甲、乙为单质,丙、丁为化合物.
甲、乙、丙、丁四种物质的转化关系如图所示,其中甲、乙为单质,丙、丁为化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用Na2CO3溶液除去锅炉中的水垢:CO32-+CaSO4═CaCO3+SO42- | ||||
| B、自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4 | ||||
| C、加入氨水调节pH至7~8,除去工业原料NH4Cl中的Fe3+:Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+ | ||||
D、用Pt电极电解MgCl2溶液:2Cl-+2H2O
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com