
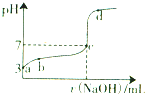
 常温下,向20mL 0.1moL/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法不正确的是( )
常温下,向20mL 0.1moL/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法不正确的是( )| A、a点表示的溶液中c(OH-)=10-11mol/L | ||
B、a、b点表示的溶液中
| ||
| C、c点表示CH3COOH和NaOH恰好完全反应 | ||
| D、d点表示的溶液中c(Na+)>c(CH3COO-) |
| 1×10-14 |
| 10-3 |
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| c(CH3COO-)?KW |
| c(CH3COOH)c(OH-) |
| c(CH3COO-) |
| c(CH3COOH)?c(OH-) |


科目:高中化学 来源: 题型:
| A、1molO2的质量为32g/mol |
| B、SO42- 的摩尔质量是96g/mol |
| C、1mol任何物质的质量等于该物质的相对分子质量 |
| D、二氧化碳的摩尔质量44g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化钙,洁净的雨水 |
| B、氢氧化钾,含铜80%的氧化铜 |
| C、澄清的石灰水,粗盐 |
| D、红磷,空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶质增加了3.5 g |
| B、有1.5 mol水被电解 |
| C、在阳极生成2 g H2 |
| D、在阳极生成16 g O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元 素 | 性 质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 在地壳中的含量位居第三 |
| F | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| G | 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知 A、B、D是三种常见的有机物,相同条件下,A 的蒸气对于H2的相对密度为 23,A 可以被氧化成 B,E 是密度最小的气体,它们之间有如图所示的转化关系(反应条件及部分产物未标出).下列说法中错误的是( )
已知 A、B、D是三种常见的有机物,相同条件下,A 的蒸气对于H2的相对密度为 23,A 可以被氧化成 B,E 是密度最小的气体,它们之间有如图所示的转化关系(反应条件及部分产物未标出).下列说法中错误的是( )| A、A中的官能团是羟基 |
| B、反应①为取代反应,反应②为置换反应 |
| C、B能与CaCO3反应 |
| D、B与F不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 气态氢化物能使湿润的红色石蕊试纸变蓝 |
| Y | 一种核素质量数为27,中子数为14 |
| Z | 单质是良好的半导体材料,广泛应用于光电信息领域 |
| W | 与Y同周期,在该周期主族元素中第一电离能最大 |
| T | 一种氧化物是生产防锈漆的原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com