
 nZ(g)+2W(g);5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应速率为0.01 mol·L-1·min-1,则上述反应中Z气体的计量系数n的值是( )
nZ(g)+2W(g);5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应速率为0.01 mol·L-1·min-1,则上述反应中Z气体的计量系数n的值是( )| A.1 | B.2 | C.3 | D.4 |
科目:高中化学 来源:不详 题型:填空题
 xC(g),2min 时反应达到平衡状态(温度保持不变),剩余0.8 molB,C的浓度为0.4mol·L-1,请填空:
xC(g),2min 时反应达到平衡状态(温度保持不变),剩余0.8 molB,C的浓度为0.4mol·L-1,请填空:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.升高温度 | B.加入少量的CuSO4溶液 |
| C.改用纯度高的锌粒 | D.改用小颗粒的锌粒 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 B,若反应物的浓度由0.1mol/L降到0.06mol/L需要20s,那么由0.06mol/L降到0.036mol/L所需反应时间应( )
B,若反应物的浓度由0.1mol/L降到0.06mol/L需要20s,那么由0.06mol/L降到0.036mol/L所需反应时间应( )| A.等于10s | B.等于12s | C.大于12s | D.小于12s |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g),若最初加入的A和B都是4 mol,测得10 s内A的平均速率v(A)=?0.12
2C(g),若最初加入的A和B都是4 mol,测得10 s内A的平均速率v(A)=?0.12 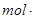
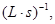 则反应进行到10 s时容器中B的物质的量是( )
则反应进行到10 s时容器中B的物质的量是( ) 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4C(g) +5D(g)。若经5s后,剩下的A是2.5mol,则B的反应速率是( )
4C(g) +5D(g)。若经5s后,剩下的A是2.5mol,则B的反应速率是( )| A.0.45 mol / (L·s) | B.0.15 mol / (L·s) | C.0.225 mol / (L·s) | D.0.9 mol / (L·s) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C+2D,在四种不同的情况下的反应速率分别为:
2C+2D,在四种不同的情况下的反应速率分别为:| A.① | B.②和③ | C.④ | D.①和④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com