
下列物质中金属键最弱而且熔点最低的是( )
A.Li B.Na
C.Al D.Rb
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:

已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是( )
A.根据现象1可推出该试液中含有Na+
B.根据现象2可推出该试液中并不含有葡萄糖酸根
C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D.根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g)
ΔH=a kJ·mol-1
3AlCl(g)===2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为________________________________________________________________________。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2===17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是
________________________________________________________________________。
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为____________。
③在0.5 mol·L-1 NaOH和1.0 mol·L-1 MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是__________(填化学式)。
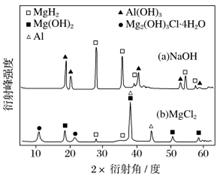
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。
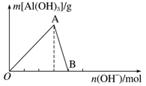
请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为__________。
(2)AB段曲线所表示的反应的离子方程式为___________________________________
________________________________________________________________________
________________________________________________________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是___________________。
(4)向含有0.1 mol NH4Al(SO4)2溶液中逐滴加入5 mol·L-1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
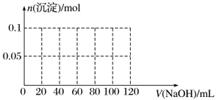
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.带相反电荷的离子之间的相互吸引称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键
D.非金属原子间可能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
气态氯化铝分子以双聚形式存在,其结构式如图所示:
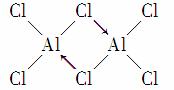
其中Cl→Al表示氯原子提供了一对电子与铝原子共享。又已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它只是一元酸。可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因,请写出下面这个化学方程式右端的两种离子的表达式:
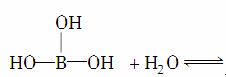 ____________________+________。
____________________+________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.σ键比π键重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有一个σ键
C.气体单质中,一定有σ键,可能有π键
D.N2分子中有一个σ键,两个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)测定NaOH溶液浓度,可用滴定管、锥形瓶、烧杯、NaOH溶液、0.100 0 mol·L-1盐酸达到目的( )
(2014·安徽理综,9D)
(2)用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低( )
(2014·大纲全国卷,6D)
(3) ( )
( )
(2014·山东理综,10B)
(4)酸式滴定管装标准溶液前,必须先用该溶液润洗( )
(2014·新课标全国卷Ⅰ,12B)
(5)酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差( )
(2014·新课标全国卷Ⅰ,12C)
(6)50 ℃时,pH=4的醋酸中,c(H+)=4.0 mol·L-1( )
(2013·广东理综,12A)
(7)50 ℃时,pH=12的纯碱溶液中,c(OH-)=1.0×10-2 mol·L-1( )
(2013·广东理综,12C)
(8)在蒸馏水中滴加浓硫酸,Kw不变( )
(2013·天津理综,5A)
(9)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同( )
(2013·天津理综,5D)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com