
分析 常用分离方法有过滤、蒸发、蒸馏、分液等,过滤用于分离可溶性物质和不溶性物质的混合物;蒸发用于分离可溶性物质和溶剂的混合物,沸点不同的混合物用蒸馏的方法,相互不溶解的液态混合物用分液的方法,以此解答.
解答 解:(1)分离可溶性物质和不溶性物质的混合物常用过滤的方法,故答案为:过滤;
(2)分离可溶性物质和溶剂的混合物常用蒸发的方法,故答案为:蒸发;
(3)分离两种相互溶解的液态混合物常用蒸馏方法,故答案为:蒸馏;
(4)分离两种相互不溶解的液态混合物常用分液方法,所用仪器的名称是分液漏斗,故答案为:分液;分液漏斗.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的实验能力的考查,注意把握物质的性质的异同以及常用实验分离操作的原理、方法以及注意事项,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH${\;}_{4}^{+}$、Cl-、S2- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO${\;}_{4}^{2-}$、I- | |
| C. | 0.1 mol•L-1NaOH溶液大量存在:K+、Na+、SO${\;}_{4}^{2-}$、CO${\;}_{3}^{2-}$ | |
| D. | 无色透明溶液中大量存在:K+、Cu2+、SO${\;}_{4}^{2-}$、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.9375d | B. | 0.9685d | C. | 1.0655d | D. | 0.9135d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
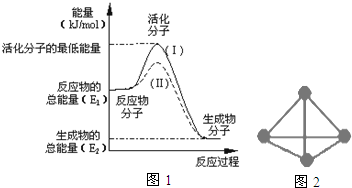
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )
把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )| A. | HCl溶液的体积为80mL | B. | a的取值范围为0≤a<50 | ||
| C. | 当a值为30时,b值为0.01 | D. | $\frac{n(Mg)}{n(Al)}$的最大值为2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
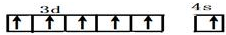 ,B在元素周期表的位置第二周期第ⅣA族
,B在元素周期表的位置第二周期第ⅣA族查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com