
高铁酸钾(K2FeO4)是一种新型的自来水处理剂,它的性质和作用是
A.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质
B.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质
C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌
D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌
科目:高中化学 来源:2015-2016学年青海省高二上9月质检化学试卷(解析版) 题型:选择题
将4 mol A气体和2 mol B气体在 2 L容器中混合并在一定条件下发生如下反应:2A(g)+B(g)= 2C (g)若经2 s后测得C的浓度为0.6 mol•L-1,现有下列几种说法,其中正确的是
①用物质A表示的反应的平均速率为0.3 mol•L-1•S-1
②用物质B表示的反应的平均速率为0.6 mol•L-1•S-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol•L-1
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2016届广东省揭阳市高三上学期第二次月考化学试卷(解析版) 题型:实验题
(15分)高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为:

已知: Ⅰ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
(1)操作①加快反应速率的措施有 (写一种)。
碳酸锶与盐酸反应的化学方程式 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为 。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为 。
A.氨水 B.氢氧化锶粉末 C.氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是 (填化学式)。
(5)步骤④的操作是 、 、过滤。
(6)工业上用热风吹干六水氯化锶但不能脱结晶水,适宜的温度是 。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列说法正确的是

A.图I所示装置用于Cu和浓H2SO4制取少量的SO2气体
B.图Ⅱ装置可验证非金属性:Cl>C>Si
C.图Ⅲ可用于收集气体H2、CO2、Cl2、NH3
D.图Ⅳ表示将SO2气体通入溴水中,所得溶液的pH变化
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期9月学情调研化学试卷(解析版) 题型:填空题
由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于刚才镀铝。工艺流程如下:

(注:NaCl熔点为801℃;AlCl3在181℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为① 和②
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有 ;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在
(3)在用废碱液处理A的过程中,所发生反应的例子方程式为 、______________。
(4)钢材镀铝后能防止钢材腐蚀,其原因是
(5)铝与过量NaOH溶液反应的离子方程式为________________________。反应后溶液中通入过量CO2,所发生反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源:2016届广东省高三上学期第二次教学质检化学试卷(解析版) 题型:推断题
[化学——选修5:有机化学基础](14分)
A(C2H2)是基本有机化工原料。由A制备聚乙烯醇缩丁醛和顺式异戊二烯的合成路线(部分反应条件略去)如图所示:

回答下列问题:
(1)A的名称是 ,B含有的官能团是 。
(2)①的反应类型是 ,⑦的反应类型是 。
(3)C、D的结构简式分别为 。
(4)3-氯-3-甲基-1-丁烯一定条件下,也可以反应得到异戊二烯,请写出反应方程式(注明条件)_________________________
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二10月月考化学试卷(解析版) 题型:填空题
( 16分)一定温度下,将3 molA气体和1 molB气体通入一密闭容器中,发生如下反应:3A(g)+B(g)  xC(g),请填写下列空白:
xC(g),请填写下列空白:
(1)若容器体积固定为 2 L,反应1 min 时测得剩余1.8 mol A,C的浓度为0.4 mol/L。
①1 min内,B的平均反应速率为__ ______;x为________。
②若反应经2 min达到平衡,平衡时C的浓度________0.8 mol/L(填“大于”、“等于”、“小于”)
③平衡混合物中,C的体积分数为22%,则A的转化率是____ ____。
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的量n(A)、n(B)、n(C)之间应满足的关系式:______ ______。
(2)若维持容器压强不变
①达到平衡时C的体积分数________22%,(填“大于”、“等于”、“小于”);
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2 倍,则应加入________mol A气体和 ________mol B气体。
查看答案和解析>>
科目:高中化学 来源:2016届四川省雅安市高三9月月考化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
B.钠与CuSO4溶液反应:2Na+Cu2+===Cu↓+2Na+
C.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O AlO2- +4NH4+ +2H2O
AlO2- +4NH4+ +2H2O
D.用双氧水和稀硫酸处理印刷电路板:Cu + H2O2 + 2H+ = Cu2+ + 2H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高二上学期10月月考化学试卷(解析版) 题型:选择题
一定温度下,下列叙述不能作为可逆反应A(g)+3B(g) 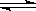 2C (g) 达到平衡状态标志的是
2C (g) 达到平衡状态标志的是
(1)C生成速率与C分解速率相等
(2)单位时间内生成amolA,同时生成3amolB
(3)A、B、C的浓度不再变化
(4)A、B、C的物质的量不再变化
(5)混合气体的总压不再变化
(6)混合气体的物质的量不再变化
(7)单位时间内消耗a molA,同时生成3a molB
(8)A、B、C的分子数之比为1:3:2
A.(2) (8) B.(1) (6) C.(2) (4) D.(3) (8)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com