
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| 浓度(c/mol•L-1) | 0.5 | 2 | 2 | 0.5 |
分析 (1)甲醇分子是极性分子;
(2)①依据化学平衡三段式列式计算,压强关系是气体物质的量的关系;
②依据平衡标志是正逆反应速率相同,各组分含量保持不变,据此分析选项;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)①甲醇燃料电池甲醇在负极失电子,碱溶液中生成碳酸盐,依据溶液中氢氧根离子配平电荷守恒;
②根据原电池原理,正极O2得到电子生成负极O2-;依据电解原理和溶液中离子放电顺序,结合电子守恒和电极反应计算得到.
解答 解:(1)甲醇分子是甲基和羟基形成的化合物是极性分子;
故答案为:极性;
(2)①工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H═-86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入Imol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的$\frac{3}{5}$,依据化学平衡三段式列式,设消耗的一氧化碳物质的量为x;
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol)1-x 2-2x x
1-x+2-2x+x=3×$\frac{3}{5}$x=0.6
一氧化碳转化率=60%;
故答案为:60%;
②CO(g)+2H2(g)?CH3OH(g)△H═-86.6KJ/mol,反应是气体体积减小的放热反应;
a.反应速率之比等于化学方程式系数之比,是正反应之比,v(H2)正═2v(CH3OH)逆,才能说明反应达到平衡状态,故A错误;
b.CO的消耗速率等于CH3OH的生成速率,说明费用正向进行,不能说明反应达到平衡状态,故B错误;
c.反应前后气体物质的量改变,容器内的压强保持不变,气体物质的量不变,说明反应达到平衡状态,故C正确;
d.气体质量不变,体积固定,混合气体的密度保持不变,不能说明反应达到平衡状态,故D错误;
e.气体质量不变,物质的量变化,混合气体的平均相对分子质量不随时间而变化,说明反应达到平衡状态,故F正确;
故答案为:ce;
(3)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H═-akJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H═-bkJ•mol-1
③H2O(g)═H2O(l)△H═-ckJ•mol-1
依据盖斯定律计算,$\frac{①+4×③-②}{2}$得到热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H═$\frac{b-a-4c}{2}$KJ/mol;
故答案为:$\frac{b-a-4c}{2}$;
(4)①燃料电池,电池的一个电极通 入空气,另一个电极通入甲醇气体,电解质是氢氧化钠溶液,根据原电池原理,正极电极反应是O2得到电子生成氢氧根离子-:O2+2H2O+4e-=4OH-,负极电极反应:CH3OH-6e-+8OH-=CO32-+6H2O;
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②燃料电池,电池的一个电极通 入空气,另一个电极通入甲醇气体,电解质是氢氧化钠溶液,根据原电池原理,正极电极反应是O2得到电子生成氢氧根离子-:O2+2H2O+4e-=4OH-,负极电极反应:CH3OH-6e-+8OH-=CO32-+6H2O;电解一段时间后,当两极收集到相同体积(相词条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),200ml溶液中含有c(Cu2+)=0.5mol/L,c(H+)=2mol/L,c(Cl-)=2mol/L,c(SO42-)=0.5mol/L;
阳极氯气和阴极氢气相同,设阳极生成的氧气物质的量为x,阴极上也应生成氢气物质的量x
阳极电极反应为:2Cl --2e-=Cl2↑,4OH--4e-=2H2O+O2↑,
0.4mol 0.4mol 0.2mol 4x x
阴极电极反应为:Cu2++2e-=Cu,
0.1mol 0.2mol 0.1mol
2H++2e-=H2↑; 2H++2e-=H2↑;
0.4mol 0.4mol 0.2mol 2x x
依据电子守恒0.4+4x=0.2+0.4+2x
x=0.1mol
阳极上收集到氧气的物质的量0.1mol,质量为3.2g;
故答案为:3.2g.
点评 本题考查了化学平衡影响因素、平衡转化率计算、热化学方程式书写和盖斯定律计算应用,电解池中电子守恒的计算分析,掌握基础是关键,题目难度中等.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题
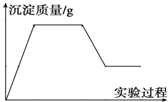 有一包白色固体物质,可能含有CuSO4、K2SO4、Na2CO3、Ca (NO3)2、KCl 中的一种或几种.将该白色固体少量溶于水中,得到无色透明溶液,取100mL该溶液先滴加足量硝酸钡溶液,再滴加足量稀硝酸,实验过程中沉淀质量的变化如图所示:
有一包白色固体物质,可能含有CuSO4、K2SO4、Na2CO3、Ca (NO3)2、KCl 中的一种或几种.将该白色固体少量溶于水中,得到无色透明溶液,取100mL该溶液先滴加足量硝酸钡溶液,再滴加足量稀硝酸,实验过程中沉淀质量的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别Na2CO3和NaHCO3可用Ba(OH)2或Ca(OH)2溶液 | |
| B. | 除去Na2CO3固体中混有的少量NaHCO3,可采用加热法 | |
| C. | CO2中混有少量HCl、SO2等气体时,可用饱和NaHCO3溶液提纯气体 | |
| D. | 将澄清石灰水滴入NaHCO3溶液中,开始时发生反应的离子方程式为:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
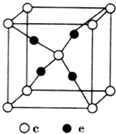 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
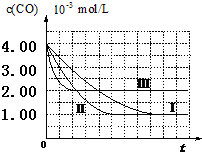 (I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.| 实验编号 | 实验目的 | T/℃ | NO初始浓度mol/L | CO初始浓度mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 6.50×10-3 | 4.00×10-3 | 120 | |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液跟过量的饱和石灰水反应 HCO3-+Ca2++OH-═CaCO3↓+2H2O | |
| B. | 向NaHSO4溶液中滴加Ba(OH)2溶液显中性H++SO42-+-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 氯化亚铁溶液中通入氯气 Fe2++Cl2═Fe3++2Cl- | |
| D. | 苛性钾溶液中加入稀盐酸 H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
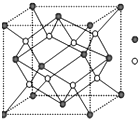 A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com