
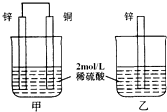
 如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )
如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )| A、甲和乙中的反应不同 |
| B、甲为原电池,H+向正极移动 |
| C、甲中铜片表面的c(H+)比乙中锌片表面的c(H+)高 |
| D、若将2mol/L稀硫酸改为2mol/LCuSO4溶液,则乙中溶液更快褪色 |


科目:高中化学 来源: 题型:
| A、2HI(g) H2?(g)+I2(g);△H>0,若降低温度,颜色加深,压强增大 |
| B、2NO2(g)?N2O4(g);△H<0,充入氩气,压强增大,红棕色变浅 |
| C、3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g);△H<0,加入铁后,Fe3O4将增加 |
| D、2SO2(g)+O2(g)?2SO3(g);△H<0,升温后,气体密度不变,平均相对分子质量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、基态锂原子的电子排布式是1s22p1 |
| B、离子晶体中可能含共价键 |
| C、熔点:Na2O>I2>SiO2 |
D、H2O2的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,11g CO2和 5.6L N2所含分子数相同 |
| B、80g NaOH溶解在1L水中,得到溶液的物质的量浓度为2mol?L-1 |
| C、标准状况下,22.4L水中所含的分子数约为6.02×1023 |
| D、标准状况下,20mL NH3跟60mL N2所含分子个数比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A、原子半径:R>Y>X |
| B、气态氢化物的稳定性:R<W |
| C、WX3和水反应形成的化合物具有挥发性 |
| D、Z的单质能和Y的最高价氧化物的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 强电解质 | HF | HClO4 | Ba(OH)2 | 食盐水 |
| 弱电解质 | Cu(OH)2 | NH3?H2O | CaCO3 | HClO |
| 非电解质 | Cu | SO2 | 蔗糖 | H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com