
| A、负极发生的反应为:Fe-2e-═Fe2+ |
| B、该电化学腐蚀过程为析氢腐蚀 |
| C、原电池是将电能转变为化学能的装置 |
| D、钢柱在水下部分比在空气与水交界处更容易腐蚀 |


科目:高中化学 来源: 题型:
| A、共价化合物中可能含有离子键 | ||||||
| B、Ca2+、K+、Cl-、S2--四种离子的半径依次减小 | ||||||
C、
| ||||||
| D、ⅥA族元素氧、硫、硒(Se)的位置从上至下,故H2O、H2S、H2Se稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应:均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应:均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:
A、 装置,过滤海带灰浸取液 装置,过滤海带灰浸取液 |
B、 装置,在滤液中通入Cl2 装置,在滤液中通入Cl2 |
C、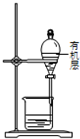 装置,先放出下层液体,再从下口放出有机层 装置,先放出下层液体,再从下口放出有机层 |
D、 装置,回收萃取剂苯并获得单质碘 装置,回收萃取剂苯并获得单质碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、都是常用的干燥剂 |
| B、常温下都能与氢前金属反应放出氢气 |
| C、一定条件下和铜反应中都表现出强氧化性和强酸性 |
| D、分别露置在空气中,容器内溶质的物质的量浓度都增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钾与水反应的离子方程式:K+H2O═K++OH-+H2↑ |
| B、向次氯酸钠溶液中通入SO2:2ClO-+SO2+H2O═SO32-+2HClO |
| C、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| D、向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH -=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时的pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全时的pH | 13 | 14 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com