
| A. | 甲醛 | B. | 甲醇 | C. | 丁烷 | D. | 丙烯 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
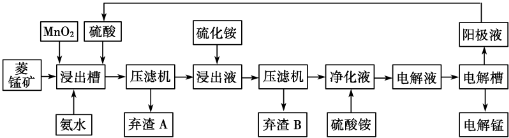
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
| 难容物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖是人体内主要供能物质,血液中葡萄糖含量过低,会使人患“低血糖”症 | |
| B. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有碳碳双键 | |
| C. | 分子式为C5H12的有机物只有三种,它们互为同系物 | |
| D. | 乙酸乙酯的水解反应;苯和硝酸反应生成硝基苯,两者的反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉-碘化钾溶液和溴水 | B. | 氢氧化钠溶液与碘水 | ||
| C. | 新制Cu(OH)2悬浊液与碘水 | D. | 碘化钾溶液与碘水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过二硫酸钾的化学式为K2S2O8,其中硫元素为+6价 | |
| B. | KMnO4和K2MnO4中原子团组成相同,其化学性质相同 | |
| C. | 有机物的分子式、结构简式、实验式都不相同 | |
| D. | 摩尔质量相同的物质,其化学式一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

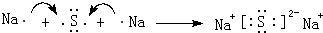 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Cl-、$MnO_4^-$、Na+ | B. | K+、Cl-、$SO_4^{2-}$、H+ | ||
| C. | OH-、Na+、Al3+、I- | D. | H+、Cl-、Ba2+、Ag+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com