
【题目】环己烯是重要的化工原料。其实验室制备流程如下:
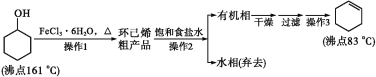
回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为__________,现象为____________。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
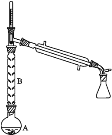
①烧瓶A中进行的可逆反应化学方程式为__________________________________,浓硫酸也可作该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因为___________(填序号)。
a.浓硫酸易使原料炭化并产生SO2
b.FeCl3·6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高
②仪器B的作用为____________________________。
(3)操作2用到的玻璃仪器是__________________________。
Ⅱ.环己烯含量的测定
在一定条件下,向a g环己烯样品中加入定量制得的b mol Br2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,用c mol·L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液V mL(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①Br2+![]() →
→![]()
②Br2+2KI=I2+2KBr
③I2+2Na2S2O3=2NaI+Na2S4O6
(4)滴定所用指示剂为__________________________。样品中环己烯的质量分数为______________________(用字母表示)。
(5)下列情况会导致测定结果偏低的是__________________(填序号)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c.Na2S2O3标准溶液部分被氧化
【答案】FeCl3溶液 溶液显紫色 ![]()
![]()
![]() +H2O a、b 减少环己醇蒸出 分液漏斗、烧杯 淀粉溶液
+H2O a、b 减少环己醇蒸出 分液漏斗、烧杯 淀粉溶液  ×100% b、c
×100% b、c
【解析】
环己醇发生消去反应生成环己烯和水,环己烯不溶于水,饱和食盐水溶解环己醇、氯化铁,然后分液得到的水相中含有环己醇、氯化铁,得到的有机相中含有环己烯,然后干燥、过滤、蒸馏得到环己烯。
Ⅰ.(1)苯酚能和氯化铁溶液发生显色反应;
(2)①烧瓶A中进行的可逆反应为环己醇的消去反应;浓硫酸具有强氧化性,能氧化原料,且FeCl36H2O污染小、可循环使用;
②仪器B能冷凝回流环己醇;
(3)操作2分离互不相溶的液体;
Ⅱ.(4)碘与淀粉变蓝;根据消耗碘单质的量可知环己烯的物质的量,然后结合m=nM计算样品中环己烯的质量分数;
(5)a.苯酚消耗的溴的物质的量偏大;
b.苯酚环己烯挥发,导致消耗的溴偏少,测定结果偏低;
c.Na2S2O3标准溶液部分被氧化,标准液消耗的体积增大。
环己醇发生消去反应生成环己烯和水,环己烯不溶于水,饱和食盐水溶解环己醇、氯化铁,然后分液得到的水相中含有环己醇、氯化铁,得到的有机相中含有环己烯,然后干燥、过滤、蒸馏得到环己烯。
Ⅰ.(1)苯酚能和氯化铁溶液发生显色反应,所以可以用FeCl3溶液检验苯酚,苯酚和氯化铁溶液混合溶液呈紫色;
(2)①烧瓶A中环己醇发生消去反应生成环己烯和水,该反应方程式为![]()
![]()
![]() +H2O;由于浓硫酸具有强氧化性,易使原料炭化并产生SO2,从而降低环己烯产率,而FeCl36H2O污染小、可循环使用,符合绿色化学理念,所以选择FeCl36H2O而不用浓硫酸,答案选a、b;
+H2O;由于浓硫酸具有强氧化性,易使原料炭化并产生SO2,从而降低环己烯产率,而FeCl36H2O污染小、可循环使用,符合绿色化学理念,所以选择FeCl36H2O而不用浓硫酸,答案选a、b;
②仪器B能冷凝回流环己醇,所以B的作用是减少环己醇蒸出,增大环己醇利用率;
(3)操作2用于分离互不相溶的液态,操作方法为分液,需要的玻璃仪器有分液漏斗、烧杯;
Ⅱ.(4)根据反应原理,反应中产生碘单质,碘与淀粉变蓝,则指示剂可选用淀粉溶液;在一定条件下,向a g环己烯样品中加入定量制得的bmolBr2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,用c mol·L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液V mL,根据反应①Br2+![]() →
→![]() ,②Br2+2KI=I2+2KBr,③I2+2Na2S2O3=2NaI+Na2S4O6,剩余Br2~ I2~2Na2S2O3,则剩余的溴单质物质的量=
,②Br2+2KI=I2+2KBr,③I2+2Na2S2O3=2NaI+Na2S4O6,剩余Br2~ I2~2Na2S2O3,则剩余的溴单质物质的量= ![]() c mol·L-1×V×10-3L=
c mol·L-1×V×10-3L=![]() mol,消耗的溴的物质的量=(b-
mol,消耗的溴的物质的量=(b-![]() )mol,由反应①可得,环己烯的物质的量=(b-
)mol,由反应①可得,环己烯的物质的量=(b-![]() )mol, 样品中环己烯的质量分数=
)mol, 样品中环己烯的质量分数= ×100%=
×100%= ×100%;
×100%;
(5)a.样品中含有苯酚杂质,苯酚和溴发生取代反应生成三溴苯酚,导致消耗的Br2的物质的量偏大,计算结果偏高,故a不符合题意;
b.在测定过程中部分环己烯挥发导致环己烯质量减少,导致测定结果偏低,故b符合题意;
c.Na2S2O3标准溶液部分被氧化,标准液消耗的体积增大,导致消耗碘的物质的量偏大,则测定的剩余溴单质的偏大,环己烯的量偏小,计算结果偏低,故c符合题意。


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】氢原子是最轻的原子,人们曾预言它可能是所有元素之母。碳是地球上组成生命的最基本的 元素之一。按要求回答:
(1)宇宙中含量最多的元素是氢和______。基态碳原子的核外电子占有______个原子轨道。
(2)光化学烟雾中除了含有 NOx 外,还含有 HCOOH、![]() (PAN)等二次污染物。
(PAN)等二次污染物。
①PAN 中 C 的杂化方式有______。1mol PAN 中含有的σ键数目为______。组成PAN 的元素的电负性大小顺序为______。
②相同压强下,HCOOH 的沸点比 CH3OCH3______(填“高”或“低”),
(3)水溶液中有 H3O+、H5O2+ 、H9O4 + 等微粒的形式。请画出 H5O2 的结构式:______。
(4)硅和碳在同一主族。下图为 SiO2 晶胞中 Si 原子沿 z 轴方向在 xy 平面的投影图(即俯视图),其 中 O原子略去,Si 原子旁标注的数字表示每个 Si 原子位于 z 轴的高度,则 SiA 与 SiB 之间的距离是______nm。
 (d 的单位为 nm)
(d 的单位为 nm)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院长春应用化学研究所在甲醇(CH3OH)燃料电池方面获得新突破,研制出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。(已知:质子交换膜的作用是只允许H+通过;甲醇在氧气中燃烧生成CO2和H2O。)

(1)该电池工作时,b处通入的物质为__,c处通入的物质为___。
(2)该电池负极的电极反应式为__。
(3)该电池工作一段时间后,当12.8g甲醇完全反应时,有___mol电子发生转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285kJ/mol
O2(g)=H2O(l) ΔH=-285kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ/mol
O2(g)=H2O(g) ΔH=-241.8kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.4 kJ/mol
O2(g)=CO(g) ΔH=-110.4 kJ/mol
④C(s)+ O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列各问:
(1)上述反应中属于放热反应的是___________。
(2)C的燃烧热为_________________。
(3)燃烧10g H2生成液态水,放出的热量为_________________。
(4)CO燃烧的热化学方程式为 ________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与NaOH醇溶液共热完全反应后,可得3种有机物的是( )
A.CH3﹣CHCl﹣CH2﹣CH3
B.
C.CH3﹣C(CH3)Cl﹣CH2﹣CH3
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代永磁体材料——钕铁硼(NdFeB)因其优异的综合磁性能,被广泛应用于计算机、通信信息等高科技产业。
(1)铁、钴、镍元素性质非常相似,原子半径接近但依次减小,NiO、FeO的晶体结构类型与氯化钠相同。基态钴原子价电子轨道表示式为_______,熔沸点:NiO_____FeO(填“<”“>”或“=”)。
(2)FeSO4·(NH4)2SO4·6H2O俗称摩尔盐,相对于FeSO4·7H2O而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是______________________。
(3)新型储氢材料氨硼烷(NH3BH3)常温下以固体稳定存在,极易溶于水。
①氨硼烷分子中B原子采取_________杂化。
②氨硼烷晶体中存在的作用力有范德华力、极性键、_______和_________。
(4)氨硼烷受热析氢的过程之一如图1所示。
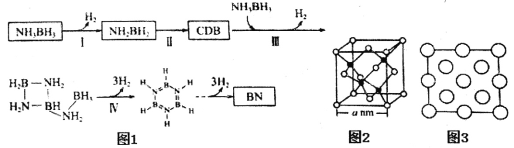
①NH2BH2的氮硼键键能大于NH3BH3,其原因为__________________________。
②CDB的结构简式为___________________________。
③立方氮化硼(BN)晶体的晶胞结构如图2所示。阿伏伽德罗常数值为NA,该晶体的密度为_______g·cm-3(用含a和NA的最简式表示)。图3是立方氮化硼晶胞的俯视投影图,请在图中用“●”标明B原子的相对位置_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某厂废水中含KCN,其浓度为0.01 mol·L-1,现用氯氧化法处理,发生如下反应(化合物中N化合价均为-3价):
KCN+2KOH+Cl2===KOCN+2KCl+H2O
(1)上述反应中被氧化的元素是________(用元素符号表示)。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:______________
______KOCN+______Cl2+______![]() ===______K2CO3+______N2+______KCl+______
===______K2CO3+______N2+______KCl+______![]()
(3)若将10 L含KCN的浓度为0.01 mol·L-1的废水中KCN氧化除去,最少需要氯气________ mol。
Ⅱ.某实验小组为了测定(3)中溶液多余Cl2的含量,常用Na2S2O3标准溶液进行定量测定。
(4)现实验室需用480 mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需________。
(5)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO![]() ,因此Na2S2O3常用作脱氯剂,该反应的离子方程式为_________________。
,因此Na2S2O3常用作脱氯剂,该反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】L-多巴是一种有机物,分子式为C9H11O4N,它可用于帕金森病的治疗,其结构简式为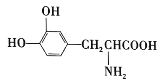 。下列关于L-多巴的叙述不正确的是( )
。下列关于L-多巴的叙述不正确的是( )
A.它属于α-氨基酸,既具有酸性,又具有碱性
B.它能与FeCl3溶液发生显色反应
C.它可以通过两分子间缩合形成分子式为C18H18O6N2的化合物,该化合物中有3个六元环
D.它既与酸反应又与碱反应,等物质的量的L-多巴最多消耗的NaOH与HC1的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.能量之间可相互转化:电解食盐水制备氯气是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4 (aq),CuSO4 (aq);铜片,铁片,锌片和导线
(1)完成原电池甲的装置示意图,并作相应的标注。要求:在同一烧杯中,电极与溶液含相同的金属元素。_____________
(2)以铜片为电极之一,硫酸铜溶液为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极________________
(3)甲乙两种原电池中可更有效地将化学能转化为电能的是____________,其原因是_________________________
(4)根据牺牲阳极的阴极保护法原理,为了减缓电解质溶液中铁片的腐蚀,在上述的材料中应选__________作阳极。
Ⅱ. CO与H2反应还可制备C2H5OH,C2H5OH可作为燃料使用,用C2H5OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
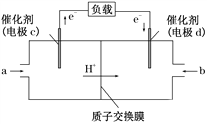
电池总反应为C2H5OH+3O2===2CO2+3H2O,则d电极是________(填“正极”或“负极”),c电极的反应方程式为_______________________________。若线路中转移2 mol电子,则上述燃料电池,消耗的O2在标况下的体积为______ L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com