
【题目】冬季是流感多发季节,最近我校许多学生得了流感,表现症状为发热头痛等,乙酰苯胺是磺胺类药物具有很好退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下:
![]()
己知:①苯胺易被氧化:
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20℃) |
乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
苯胺 | -6℃ | 184.4℃ | 3.4 |
醋酸 | 16.6℃ | 118℃ | 易溶 |
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。

实验步骤如下:
步骤1:在50mL烧瓶中加入9mL(0.10mol)苯胺、15mL(0.27mol)冰醋酸及少许锌粉,依照上图装置组装仪器。
步骤2:控制温度计示数约105℃,小火加热回流1h。
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
步骤4:将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g。
请回答下列问题:
(1)步骤1中加入锌粉的作用是________________________________。
(2)步骤2加热可用_________________(填“水浴”或“油浴”)
(3)锥形瓶所接的蒸馏物是______________(填化学式)。实验这样设计的目的是__________________。
(4)步骤2中,控制温度计读数在105℃左右的原因_______________,得到的粗产品需进一步提纯,该提纯方法是________________________________________________________。
(5)纯净的乙酰苯胺为无色片状晶体,对无色片状晶体进行干燥,判断晶体干燥完全的实验方法是___________________________________________。
(6)请计算所得到乙酰苯胺的产率是_________________________________________________。
【答案】 防止苯胺被氧化 油浴 H2O 提高产率 温度过高,未反应的乙酸蒸出,降低反应物的利用率。温度过低,又不能除去反应生成的水 重结晶 两次称量的质量差小于0.1g 80%
【解析】(1)苯胺易被氧化,锌是较活泼的金属,可用来除去装置内的氧化性物质,从而保护苯胺;
(2)加热需要的温度为105℃,所以用油浴加热,受热均匀,保持长时间恒温;
(3)要控制在105℃加热,根据表中所给物质的沸点可知,锥形瓶内收集的是水(H2O),水作为反应的生成物从反应体系中分离出去,有利于反应正向进行,提高产率;
(4)控制在105℃加热,是为了防止乙酸大量蒸出,导致反应物的转化率降低,同时又能分离出反应生成的水,促进反应正向进行,提高产物的产率;得到的粗产品中含有少量的苯胺,由于乙酰苯胺的溶解度小于苯胺,所以可用重结晶的方法进行提纯;
(5)随着干燥的进行,产品质量会发生变化,当两次称量的质量相差小于0.1g时,就说明干燥完全;
(6)已知乙酸过量,苯胺的物质的量为0.10mol,所以理论上可生成乙酰苯胺0.10mol,其摩尔质量为135g/mol,则该产品的产率为=![]() 。
。


科目:高中化学 来源: 题型:
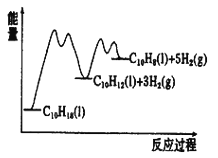
【题目】(一)十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:ΔH1>ΔH2>0
C10H18(l)![]() C10H12(l)+3H2(g) ΔH1
C10H12(l)+3H2(g) ΔH1
C10H12(l)![]() C10H8(l)+2H2(g) ΔH2
C10H8(l)+2H2(g) ΔH2
请回答:
(1)则C10H8(l)+5H2(g)![]() C10H18(l) ΔH3=___________。
C10H18(l) ΔH3=___________。
(2)有利于提高上述反应平衡转化率的条件是:___________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)研究表明,将适量十氢萘置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是:_______________________________。
(4)温度335℃时,在恒容密闭反应器中进行高压液态十氢萘(1.00mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间的变化关系,如下图所示。
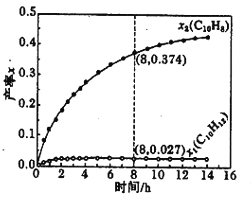
在8h时,反应体系内氢气的量为:_________ mol(忽略其他副反应)。
②已知反应过程中的能量变化如图所示,x1显著低于x2的原因是:_________________________。
(二)科学家发现,以H2O和N2为原料,熔融NaOH—KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。
(5)阴极区发生的变化可视为按两步进行。先发生的电极反应式为:________________________,随后发生反应:2Fe+3H2O+N2==2NH3+Fe2O3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是( )
A.乙醇与溴化氢的水溶液共热:CH3CH2OH+HBr→CH3CH2Br+H2O
B.甲烷和氯气在光照条件下的反应:2CH4+Cl2 ![]() 2CH3Cl+H2
2CH3Cl+H2
C.苯酚溶液中滴入NaOH溶液:H++OH﹣→H2O
D.苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O﹣→2C6H5OH+2CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一原电池的结构示意图,下列说法中,错误的是( ) 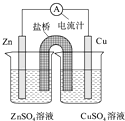
A.Cu电极为正电极
B.原电池工作时,电子从Zn电极流出
C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu
D.盐桥(琼脂﹣饱和KCl溶液)中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为:Zn﹣2e﹣+2OH﹣=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3﹣3e﹣+5OH﹣=FeO42﹣+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月18日,中国国土资源部地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个海域试采可燃冰成功的国家,可燃冰即天然气水合物,甲烷含量占80%至99.9%。化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g) △H1 =-36kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2 =+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,每生产lmolCO,转移电子的数目为__________。
(2)甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1 =-90kJ·mol-1 K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2 K2
己知:CO(g)+H2O(g)= CO2(g)+H2(g) △H3 =-41.1kJ·mol-1 K3
H2O(l)=H2O(g) △H4 =+44.0kJ·mol-1 K4
则△H2=______ K2=_______ (用含K1、K3、K4的代数式表示)
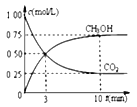
(3)在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)十3H2(g) ![]() CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)
①下列能说明该反应已达到平衡状态的是______________________。
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为_____________(用含P的代数式表示,数值保留两位小数),若此时再向容器内充入0.25molCO2和0.25molCH3OH的混合气体,则平衡______(填“正向“逆向“不”)移动。(已知:气体分压=气体总压×体积分数)
(4)甲醇可在电解银催化作用下制甲醛,从贵金属阳极泥中可提取“粗银”“粗银”(含Ag、Cu、Au)可用电解槽电解精炼,纯银作阴极,采用AgNO3和稀HNO3的混合液作电解液,阴极的主要电极反应式为_____。阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为_______。硝酸浓度不能过大,其原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾. 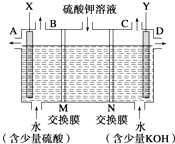
(1)X极与电源的(填“正”或“负”)极相连,氢气从(填“A”、“B”、“C”或“D”)口导出.
(2)离子交换膜只允许一类离子通过,则M为(填“阴离子”或“阳离子”)
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的反应式为 .
(4)若在标准状况下制得11.2L氢气,则生成硫酸的质量是 , 转移的电子数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的叙述正确的是
选项 | 实验方案 | 实验目的或结论 |
A | 将一片铝箔置于酒精灯外焰上灼烧 | 通过现象铝箔熔化而不滴落证明铝箔只发生了物理变化 |
B | 用玻璃棒蘸取氯水滴到pH试纸上,对比标准比色卡颜色 | 通过颜色变化可测定氯水的pH |
C | 往乙醇中加入适量浓硫酸制备乙烯,并将产生的气体直接通入酸性KMnO4溶液中 | 通过现象KMnO4褪色可证明乙烯能被酸性高锰酸钾氧化 |
D | 取少量溶液于试管中,加入NaOH溶液并加热,用湿润红色石蕊试纸检验产生的气体 | 通过试纸变色情况可检验原溶液中是否含有NH4+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关.下列叙述正确的是( )
A.鲜榨橙汁遇到碘水会变蓝
B.馒头越嚼越甜
C.油脂经碱性水解可制得肥皂
D.土豆中的淀粉经水解可变成酒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com