
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 ,第一电离能最小的元素是 (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是
(填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、
另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6
pm,则此晶胞的密度为 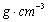 (保留两位有效数字)。(
(保留两位有效数字)。( )
)
(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构
如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出
上述过程的离子方程式: 。
【知识点】原子核外电子排布、晶胞计算、化学键
【答案解析】
(1)
| ↑↓ | ↑↓ | ↑↓ | ↑ |
3s 3p
(2)HF>HI>HBr>HCl (1分) HF分子之间形成氢键使其熔沸点较高,HI、HBr、HCl分子之间只有范德华力,相对分子量越大,范德华力越大(2分)
(3)sp2(1分) 34%(2分)
(4)面心立方最密堆积(1分) ①②③(1分)
(5)首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液(1分)
Cu2++2NH3·H2O===Cu(OH)2↓+2NH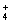 、Cu(OH)2+4NH3===[Cu(NH3)]2++2OH-(各1分,共2分)
、Cu(OH)2+4NH3===[Cu(NH3)]2++2OH-(各1分,共2分)
解析:由题意得A为氢元素,B为碳元素,C为氯元素,D为29号元素是铜元素。
(1)电负性最大的是氯元素,M层有7个电子其基态原子的价电子排布图为
| ↑↓ | ↑↓ | ↑↓ | ↑ |
第一电离能最小的是铜元素,填Cu
3s 3p
(2)卤族元素的氢化物沸点由高到低的顺序是HF>HI>HBr>HCl ,HF分子之间形成氢键使其熔沸点较高,HI、HBr、HCl分子之间只有范德华力,相对分子量越大,范德华力越大,熔沸点较高。
(3)图一中每个碳原子形成3个ρ键,形成3个杂化轨道,所以是sp2杂化。图二为金刚石晶胞中有8个原子,顶点一个、面心三个、晶胞内四个。这样可算原子体积。而晶胞中只有体对角线上的原子是密置的,体对角线与晶胞边长a的关系是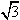 a =8r,算出来的空间利用率是34.0%。
a =8r,算出来的空间利用率是34.0%。
(4)铜晶胞为面心立方最密堆积,图三醋酸铜晶胞中碳氧键、碳氢键为极性键,碳碳键为非极性键,铜氧间是配位键。选 ①②③。
(5)首先形成Cu(OH)2蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液。化学反应为:Cu2++2NH3·H2O===Cu(OH)2↓+2NH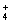 、Cu(OH)2+4NH3===[Cu(NH3)]2++2OH-
、Cu(OH)2+4NH3===[Cu(NH3)]2++2OH-
【思路点拨】本题考查原子核外电子排布、晶胞计算、化学键,注意结构的计算,难度中等。


科目:高中化学 来源: 题型:
G是一种合成橡胶和树脂的重要原料,A是C、H、O三种元素组成的五元环状化合物,相对分子质量为98,其核磁共振氢谱只有一个峰;F的核磁共振氢谱有3个峰,峰面积之比为2:2:3。已知:(其中R是烃基)

有关物质的转化关系如下图所示,请回答以下问题。
(1)A中不含氧的官能团的名称是 ;⑤的反应类型是 。G的结构简式为 ;G与Br2的CCl4溶液反应,产物有 种(不考虑立体异构)。
(2)反应②的化学方程式为 。
(3)E可在一定条件下通过 (填反应类型)生成高分子化合物,写出该高分子化合物可能的结构简式: (两种即可)。
(4)反应⑥的化学方程式为 。
(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的Y的结构简式: 。Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关晶体的叙述中,正确的是( )
A、 在Si晶体中,Si原子与Si-Si键之比为1:4
B、在NaCl晶体中,每个Na+周围距离最近的Na+有6个
C、在CsCl晶体中,与每个Cs+紧邻的Cs+有8个
D、在面心立方堆积的金属晶体中,每个金属原子周围紧邻的有12个金属原子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列 表示对应化学反应的离子方程式正确的是
表示对应化学反应的离子方程式正确的是
A.用白醋除铁锈:Fe2O3+6H+===3H2O+2Fe3+
B.向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:
Ba2++ 2OH-+NH + HCO
+ HCO
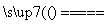 NH3↑+2H2O+BaCO3↓
NH3↑+2H2O+BaCO3↓
C.用过量冷氨水吸收SO2:SO2+NH3·H2O===HSO +NH
+NH
D. 用强碱吸收工业制取硝酸尾气:NO+ NO2+2OH-===2NO +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
五种短周期元素的某些性质如下表所示:
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12 m) | 37 | 99 | 66 | 104 | 154 |
| 主要化合价 | +1 | -1、+7 | -2 | -2、+6 | +1 |
下列说法正确的是( )
A.由Q与Y形成的化合物中只存在离子键
B.Z与X之间形成的化合物具有还原性
C.X、Y元素组成的化合物的沸点高于X、Z元素组成化合物的沸点是由于Y非金属性比Z强
D.Y、Q、W三种元素组成化合物的水溶液一定显碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com