
| A. | Bi3Ge3O15 | B. | Bi4Ge3O12 | C. | Bi4Ge3O16 | D. | Bi3Ge3O12 |
分析 根据根据Ge与Si同族,锗(Ge)元素为+4价,得到氧化物的化学式,再N与Bi同主族,最外层有5个电子,形成三对共用电子对即达8电子结构,故在BGO中呈+3价,得到氧化物的化学式,根据信息中在BGO中,两种氧化物所含氧的质量相同,BGO可看成由锗和铋两种元素的氧化物所形成的化合物来解答;
解答 解:因锗(Ge)元素为+4价,则其氧化物的化学式为GeO2,铋元素(Bi)的化合价表现为+3,则其氧化物的化学式为Bi2O3,由两种氧化物所含氧的质量相同,则BGO的化学式可写成:3GeO2•2Bi2O3,即化学式为Bi4Ge3O12,故选B.
点评 学生应对信息习题充分认识信息在解答中的重要作用,本题中在BGO中,两种氧化物所含氧的质量相同,BGO可看成由锗和铋两种元素的氧化物所形成的化合物是解答化学式的关键.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲一定是烷烃 | |
| B. | 乙的物质的量为0.05mol | |
| C. | 符合条件的乙的可能结构有3种(包含顺反异构) | |
| D. | 甲的质量为2.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和滴定实验中,如用于装标准液的滴定管洗净、干燥后,未经润洗,测定结果偏高 | |
| B. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 | |
| C. | 纸层析实验中若选择水做固定相,有机溶剂做流动相,则亲水性强的成分在流动相中分配的少一些,在毛细现象作用下,随流动相移动的速度快一些 | |
| D. | 检验新鲜鸡血中的铁元素时,可在鸡血中加入稀硝酸并加热搅拌蒸干得到固体粉末,取少许粉末加入亚铁氰化钾稀溶液,可得蓝色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水溶液的浓度等于氢氧化钠溶液 | |
| B. | NH3•H2O的电离方程式:NH3•H2O=NH4++OH- | |
| C. | c(NH3•H2O)+c(NH4+)=0.01 mol•L-1 | |
| D. | 往等体积的两溶液中加入盐酸恰好中和,消耗盐酸多的溶液pH值小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
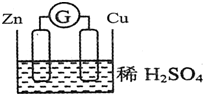 请观察如图装置,回答下列问题:
请观察如图装置,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CuCl2、Cu(NO3)2、Ba(OH)2 | B. | Al、Fe、CuSO4 | ||
| C. | MgSO4、Mg(NO3)2、Ba(OH)2 | D. | Al、Cu、FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com