
用乙炔原料制取CH2Br—CHBrCl,可行的反应途径是 ( )
A .先加Cl2,再加Br2 B .先加Cl2,再加HBr
C .先加HCl,再加HBr D .先加HCl,再加Br2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
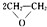
| ||
| ||
| 加热、加压 |
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | ||||||||
| 乙炔 | CaCO3
| |||||||
| 乙烯 | 来源于石油裂解气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
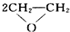
| ||
| 催化剂 |
| 加热加压 |
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | ||||||||
| 乙炔 | CaCO3
| |||||||
| 乙烯 | 来源于石油裂解气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醛是重要的化工原料。目前工业上使用两种方法制取乙醛
(1)乙炔水化法: CH≡CH+H2O![]() CH3CHO
CH3CHO
(2)乙烯氧化法: CH2=CH2 + O2 ![]() CH3CHO
CH3CHO
有关信息为
| 物质 项目 | 乙炔水化法 | 乙烯氧化法 |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4(催化剂) 100℃~125℃ | PdCl2~CuCl2(催化剂) 100℃~125℃ |
| 平衡转化率 | 乙炔转化率 90% | 乙烯转化率 80% |
| 反应速率 | 较 慢 | 较 快 |
| 原料来源生产工艺 | CaCO3 CaC2 | 石油裂解气 |
(1)实验室用乙醇氧化制乙醛的化学方程式_______________________ ;
(2)乙醛与新制Cu(OH)2反应的化学方程式_____________________________ 。
(3)某裂解气中各成分的体积分数分别为:甲烷5%、乙烯40%、丙烯10%、丁二烯(C4H6)10%、氢气35 % ,将其通入溴水充分反应,干燥后剩余气体的平均相对分子质量为____________(精确到0.01)。
查看答案和解析>>
科目:高中化学 来源:2009年浙江省高考化学模拟试卷(二)(解析版) 题型:解答题


 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O 2CH3OH
2CH3OH| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3 CaO CaO CaC2 CaC2 C2H2 C2H2 |
| 乙烯 | 来源于石油裂解气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com