

分析 由流程可知,X与盐酸反应生成蓝色溶液,则一定含Cu、Fe2O3,发生Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,4.92g固体与过量NaOH反应,最终得到1.92g固体,则1.92g固体应为Cu,Al2O3、SiO2至少含一种,但氧化铝与酸反应,则II中发生SiO2+2NaOH═Na2SiO3+H2O,以此来解答.
解答 解:由流程可知,X与盐酸反应生成蓝色溶液,则一定含Cu、Fe2O3,发生Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,4.92g固体与过量NaOH反应,最终得到1.92g固体,则1.92g固体应为Cu,Al2O3、SiO2至少含一种,但氧化铝与酸反应,则II中发生SiO2+2NaOH═Na2SiO3+H2O,
(1)由上述分析可知,Ⅰ得到蓝色溶液,该过程中一定发生的化学反应为Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,
故答案为:Fe2O3+6H+═2Fe3++3H2O;Cu+2Fe3+═2Fe2++Cu2+;
(2)由上述分析可知,反应II为SiO2+2NaOH═Na2SiO3+H2O,X中一定含有的物质是Fe2O3、Cu、SiO2,故答案为:SiO2+2NaOH═Na2SiO3+H2O;Fe2O3、Cu、SiO2.
点评 本题考查物质组成及含量的实验,为高频考点,把握实验流程中的反应及成分推断为解答的关键,侧重分析、推断能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 814.8 | 400.3 | 97.3 |
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 137.7 | 428.8 | 97.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | NaOH | C. | AgNO3 | D. | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3:2 | B. | 4:3 | C. | 4:1 | D. | 2:l |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
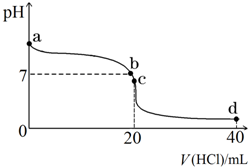 室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.
室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com